Structure et réplication du virus de l'hépatite B
II. Structure du génome
(figure 1)
Avec ses 3 200 paires de bases, c'est le plus petit des virus humains à ADN. Il code seulement 4 gènes :
- Le gène C, avec une zone pré-C, pour la capside ou core, constituée de l'antigène HBc de 21 000 de poids moléculaire (21 kDa).
- Le gène S, avec une zone pré-S1 et une zone pré-S2, pour l'enveloppe, constituée d'antigène HBs (s pour surface). Cet antigène HBs se présente sous trois formes : petite, moyenne et grande, de 24, 33 et 39 kDa, selon qu'il vient de l'expression du gène S, de pré-S2 + S, ou pré-S1 + pré-S2 + S.
- Le gène P, pour la polymérase, plus précisément l'ADN polymérase, de 90 kDa.
- Le gène X, aux fonctions mal connues, transactivatrices, peut-être impliqué dans la cancérogenèse par le VHB.
Quatre gènes dans un si petit génome, cela implique une organisation particulière, très économe : l'ADN viral est circulaire, à 2 brins sur 50 à 80 % de sa longueur, et surtout, ses 3 cadres de lecture sont mis à contribution, de sorte que les gènes se chevauchent, utilisant au mieux les capacités génétiques réduites de ce virus. Le gène P, le plus long des quatre, correspondant aux trois quarts du génome, chevauche ainsi entièrement le gène S et partiellement les gènes C et X.
II. L'antigène HBs
Par sa position, c'est la structure d'attachement du virus sur la cellule cible, l'hépatocyte, précisément par sa partie préSl. Il constitue l'essentiel de l'enveloppe du virus. Cette enveloppe diffère sensiblement de l'enveloppe "classique" de virus comme les herpèsvirus, les myxovirus (grippe), les paramyxovirus (rougeole, virus RS...), les arbovirus ou le VIH. Pour ces virus, l'enveloppe appelée également péplos (manteau, en grec) dérive par bourgeonnement des membranes nucléaires ou cytoplasmiques, elle est ainsi faite d'une bicouche lipidique parfaitement visible et agrémentée de glycoprotéines virales sous forme de spicules. Ces virus à péplos partagent la fragilité des membranes cellulaires et sont de ce fait rapidement inactivés dans le milieu extérieur et transmis uniquement par des contacts interhumains rapprochés. Au contraire, le VHB est à ranger parmi les virus relativement résistants comme certains virus nus, sans enveloppe, même si son enveloppe constituée au niveau de la membrane cytoplasmique de l'hépatocyte associe à l'antigène HBs des molécules de glycoprotéines et de lipides cellulaires. Ainsi, l'infection à VHB est beaucoup plus contagieuse que l'infection à VIH. Ces deux virus partagent une transmission par le sang, le sexe et les relations materno-foetales, mais le risque de transmission est bien plus élevé dans le cas du VHB. Le risque d'infection par accident d'exposition au sang (AES) du fait d'une piqûre a été estimé à 30 % en ce qui concerne le VHB, 3 % pour le VHC et 0,3 % pour le VIH. Les soins aux malades - lorsque sont respectées les conditions d'hygiène - et la vie en famille sans rapport sexuel auprès d'un parent infecté ne présentent pas de risque en matière de VIH, alors qu'au contraire les personnels soignants ont, avant la généralisation de la vaccination contre l'hépatite B, été souvent victimes du VHB, en particulier dans les services d'hémodialyse, de réanimation médicale ou chirurgicale, en cabinet de soins dentaires, en laboratoires d'analyses biologiques. D'autre part, le VHB se transmet assurément "sous le toit". Tout cela en raison de la résistance du virus que l'on peut objectiver comme suit : il résiste à l'éther, contrairement aux virus à enveloppe classique ; il se conserve au moins 20 ans au congélateur à - 20°C, supportant très bien les cycles de congélation-décongélation ; il résiste 60 minutes à 37°C ; des sérums laissés 6 mois à 30-32°C restent infectieux. Il faut pour l'inactiver dans le sérum une concentration d'hypochlorite de soude de 5 % (eau de Javel pure), alors que d'habitude la plupart des virus sont détruits par l'hypochlorite de soude à 0,5 %.
En ce qui concerne sa structure antigénique, l'antigène HBs comporte au moins 5 spécificités : le déterminant majeur (a) est commun à toutes les souches, donc spécifique de groupe ; les anticorps correspondants suscités par l'infection naturelle quand elle évolue vers la guérison, ou par la vaccination, sont neutralisants, protecteurs. S'ajoutent à cela deux paires de déterminants de sous-type, les déterminants de chaque paire étant mutuellement exclusifs. Ainsi, 4 sous-types d'antigènes HBs ont été définis : adw, ayw, adr et ayr, de répartition géographique distincte. Par exemple, adw prédomine dans le Nord de l'Europe, en Amérique du Nord et en Amérique du Sud, en Australie, tandis que ayr se rencontre dans le Nord et l'Est de l'Afrique, l'Est de la Méditerranée, l'Est de l'Europe, le Nord et le Centre de l'Asie, l'Inde. A vrai dire, les progrès des techniques d'analyse des génomes viraux favorisent désormais le génotypage du VHB, des amorces spécifiques permettant en PCR de distinguer les génotypes de A à H.
III. L'antigène HBc et l'antigène HBe
1. L'antigène HBc
L'antigène HBc, qui constitue le core ou capside, est exprimé à la surface des hépatocytes où il induit des réactions de cytolyse de la part des lymphocytes T CD8+. Cependant, contrairement à l'antigène HBs, il n'apparaît pas dans le sérum. En revanche, on trouve dans le sérum au stade de multiplication virale active de l'antigène HBe qui représente le troisième antigène associé à l'infection virale.
2. L'antigène HBe
Plus petit que l'antigène HBc (17,5 kDa), il est, comme l'antigène HBc, codé par le gène C, mais il lui manque 34 à 36 acides aminés de l'extrémité carboxy-terminale de l'antigène HBc et il a, à l'opposé, 10 acides aminés de la région pré-C qui manquent à l'antigène HBc. Cette séquence supplémentaire est un peptide signal qui rend compte du passage de l'antigène HBe dans le système réticulo-endothélial et de son excrétion dans le sérum.
IV. L'ADN polymérase
Elle est associée à la particule virale et pénètre donc dans la cellule en même temps que le virus. Elle fonctionne comme ADN polymérase à la fois ADN-dépendante (sur matrice d'ADN) et ARN-dépendante (sur matrice d'ARN). C'est donc aussi une rétrotranscriptase (RT), avec des homologies de séquences avec la RT du VIH et une sensibilité commune à l'analogue nucléosidique qu'est la 3TC. Elle a également une activité ARNase H.
### Ce qu'il faut retenir
#### 1. L'antigène HBs
|
V. Multiplication du VHB
1. Supports de la multiplication virale
L'homme est le seul hôte naturel. L'infection du chimpanzé et d'autres primates en captivité a été attribuée principalement à la fréquentation de l'homme. Cependant, on a également observé la circulation, chez ces animaux, de variants particuliers du VHB. Ceux-ci suscitent d'intéressantes questions sur l'origine du VHB, mais cette infection des primates ne joue actuellement pas de rôle dans l'épidémiologie humaine.
Les cellules permissives sont les hépatocytes, bien que de l'ADN viral ait été trouvé en faible quantité dans des sites extra-hépatiques, monocytes, lymphocytes B, lymphocytes T CD4+ et CD8+. C'est sans doute à mettre en rapport avec les réinfections du greffon, observées après transplantation de foie, en particulier chez les patients atteints d'hépatite chronique sévère.
Cela étant, la multiplication in vitro du VHB, que l'on peut obtenir en cultures primaires d'hépatocytes, ou dans certaines lignées continues de cellules conservant les propriétés des cellules hépatiques, apparaît fort limitée par comparaison à ce qu'on observe in vivo chez l'homme.
2. Cycle de multiplication du virus (figure 2)
Après entrée dans l'hépatocyte, la forme circulaire ouverte et partiellement bicaténaire de l'ADN viral se trouve, sous l'action de l'ADN polymérase virale incluse dans la particule virale, transformée en forme bicaténaire circularisée sous tension : c'est le cccDNA, pour covalently closed circular DNA, appelé aussi supercoiled DNA, pour ADN surenroulé ou torsadé. Cet ADN surenroulé est une sorte de minichromosome détecté dans le noyau où il sert de matrice pour la transcription d'ARN viraux de différentes tailles : le plus long de ces transcrits, qui contient toute l'information génétique du virus, est un "progénome", tandis que des transcrits plus courts sont les ARN messagers correspondant aux 4 gènes du virus et sont bientôt traduits en protéines virales. Ultérieurement, le progénome ARN est encapsidé par l'antigène HBc avec l'ADN polymérase qui, fonctionnant comme RT, douée également d'une action ARNase H, fabrique, à partir de ce progénome d'ARN, le génome d'ADN définitif et digère le progénome. Cette opération est très particulière aux hepadnavirus et à un virus des plantes, le virus de la mosaïque du chou-fleur. Elle n'est pas identique à la rétrotranscription du VIH car, si l'on observe parfois de l'ADN viral intégré dans l'ADN cellulaire, cette intégration n'est pas indispensable, ni à la réplication du VHB en phase active, ni à son pouvoir cancérigène. D'autre part, le VHB, contrairement au VIH, ne code pas d'intégrase. Cependant, il y a une homologie de séquence entre VIH et VHB, dont la polymérase partage le site catalytique caractérisé par la séquence YMDD.

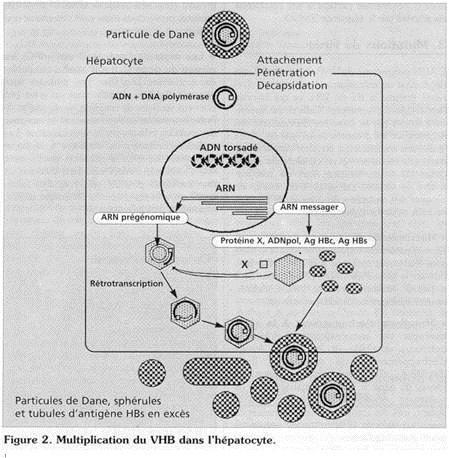
Dans le noyau, l'ADN-polymérase uiral associé au uirion complète l'ADN génomique partiellement bicaténaire en ADN bicaténaire circulaire surenroulé (supercoiled, torsadé). Celui-ci est transcrit par l'appareillage cellulaire en ARN : ARN-messagers, traduits en 4 protéines (HBs, HBc, ADN polymérase et x) et ARN prégénomique, particularité du VHB. Ce dernier est rétrotranscrit par l'ADN-polymérase en nouueaux ADN génomiques. Ainsi, l'ADN-polymérase virale a une double activité : c'est une ADN-polymérase ADN-dépendante classique et une rétrotranscriptase, d'où son inhibition par la 3TC, nucléoside anti-VIH.
### Ce qu'il faut retenir
|
3. Mutations du virus
L'ADN polymérase du VHB, à activité RT, est dépourvue de mécanisme de correction d'erreurs, comme la RT du VIH, ce qui favorise l'apparition de mutations. Celle-ci est cependant limitée par le caractère chevauchant des 4 gènes sur les 3 cadres de lecture de l'ADN viral : une mutation sur un gène donne forcément une mutation sur un ou deux des autres gènes du virus, risquant alors de compromettre la viabilité du virus. Cela étant, on observe des mutations du gène P, de l'antigène HBs et de l'antigène HBc.
a) Mutations de résistance à la 3TC
Elles apparaissent régulièrement après 6 mois sous traitement prolongé à la 3TC. Elles portent sur le gène P de l'ADN polymérase. Il n'y a pas de résistance croisée avec l'Adéfovir, nouvel analogue nucléosidique antiviral.
b) Mutations d'échappement à la sérothérapie
Par immunoglobulines riches en anticorps anti-HBs et en même temps d'échappement à la vaccination (faite d'AgHBs) : elles consistent en mutations au niveau du gène S. Elles apparaissent lors de traitement préventif de la transmission mèreenfant, lors des campagnes de vaccination de masse, ou lors de la sérothérapie préventive pour éviter l'infection du greffon chez les transplantés de foie. Elles n'ont pas jusqu'à présent conduit à modifier la stratégie de ces mesures préventives mais sont clairement une invitation à la vigilance.
c) Les mutants "précore" ou pré-C, au niveau du gène C
Il sont rendus incapables de synthétiser l'AgHBe. Les malades sont devenus AgHBe négatifs mais ce n'est pas chez eux un signe de contrôle, de rémission de l'infection virale, comme ce serait le cas pour des malades infectés par le virus classique. Les malades continuent au contraire à répliquer activement ce virus à mutation pré-C, avec une abondance d'ADN viral dans le sérum, et une évolution possible vers l'hépatite fulminante ou vers une hépatite chronique sévère, répondant mal à l'interféron.
### Ce qu'il faut retenir
|
Pour en savoir plus
Lee W.M. Medical Progress : Hepatitis B Virus infection. Review articles. N Engl J Med 1997; 337 : 1733-45. Zuckerman A.J. Hepatitis viruses. In: Zuckerman A.J., Banatvala J.E., Pattison J.R. Principles and practice of clinical virology (Third edition). John Wiley & Sons Ltd., 1995, p.153 - 87.
Robinson W.S. Hepadnavirus. In: Mandell G.L., Bennett J.E., Dolin R. Principles and practice of infections diseases (Fifth edition). Churchill Livingstone, 2000, p. 1652 - 84.
Développement et Santé, n°151, février 2001