Réalisation des biopsies cutanées
Une biopsie cutanée bien faite apporte d'inestimables renseignements dans de nombreuses maladies dermatologiques ou non dermatologiques. Elle peut être faite dans un dispensaire périphérique et envoyée par la poste dans un hôpital sans que le patient soit obligé de s'y rendre d'emblée. Elle permet, le plus souvent, de préciser un diagnostic et de décider d'un traitement adapté.
Dans ce paragraphe nous abordons d'une manière résumée les indications des biopsies cutanées qui, à elles seules, pourront faire l'objet d'un article ultérieur.
I. Indications
Les biopsies cutanées sont indispensables dans le diagnostic des tumeurs cutanées : épithélioma et carcinome basocellulaires, spinocellulaires, sarcome cutané tel que la maladie de Darier Ferrand ou la maladie de Kaposi, etc. Pour le mélanome malin, heureusement rare en Afrique, l'idéal est de faire une exérèse chirurgicale large d'emblée. Parfois, la maladie sera découverte par hasard sur une biopsie cutanée.
Les biopsies cutanées sont également très nécessaires dans certaines maladies infectieuses, microbiennes, parasitaires, mycoses profondes ou superficielles. Quand cela est possible, et que l'on suspecte une maladie infectieuse, l'idéal est de faire d'une part la biopsie cutanée pour le laboratoire d'anatomie pathologique, et d'autre part le prélèvement pour le laboratoire de mycologie, de parasitologie ou de bactériologie. À l'occasion de la biopsie cutanée, on peut réaliser de simples appositions sur lames du fragment biopsié, utiles, par exemple, dans le diagnostic d'une leishmaniose cutanée, après coloration par May-Grunwald Giemsa. La biopsie cutanée en pathologie infectieuse est très nécessaire pour le diagnostic de la lèpre tuberculoïde, lépromateuse, borderline ou indéterminée. Elle sert également pour le diagnostic de la tuberculose cutanée, des mycobactérioses cutanées en général, des leishmanioses, onchocercose, larva migrans, blastomycose, chromobastomycose, etc.
La biopsie cutanée est enfin très importante pour les maladies plus dermatologiques : lichen plan, eczéma, sarcoïdose de Besnier Boeck Schauman, taxidermie due à un médicament (éruption survenant après la prise de sulfamide par exemple), sclérodermie, vascularite allergique avec leucocytoclasie, etc.
II. Choix de la zone à biopsier
Ordinairement, la biopsie se fait à cheval entre la zone anormale et la peau saine. La biopsie devra être plus profonde pour les lésions hypodermiques (érythème noueux, fasciite, etc.). L'incision se fera de préférence parallèle aux lignes de traction naturelle de la peau pour faciliter la cicatrisation et éviter le lâchage des sutures.
III. Réalisation de la biopsie
Une biopsie à visée diagnostique n'est pas une exérèse. Elle ne doit être ni trop petite (difficulté de l'examen anatomo-pathologique), ni trop grande (en moyenne 1,5 x 0,5 cm ou bien 2 x 0,5 cm). N'oublions pas qu'il y a une rétraction importante de la peau dans le fixateur. Le fragment biopsique va spontanément perdre 30 à 50 % de son volume apparent. La biopsie cutanée doit être d'autant plus grande qu'il peut y avoir une partie à envoyer au laboratoire de microbiologie.
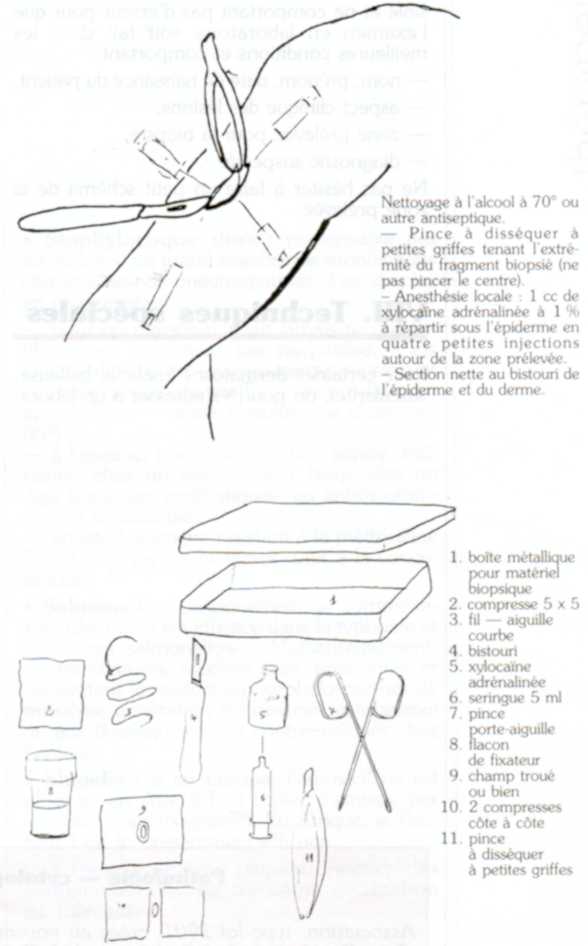
Le patient est allongé pour la réalisation de cette biopsie cutanée. On réalise une anesthésie locale de la zone à biopsier, après nettoyage à l'alcool à 70°; ou avec un autre antiseptique. L'anesthésie locale est faite avec la xylocaïne à 1 % adrénalinée par plusieurs petites injections superficielles autour de la zone qui va être prélevée (environ 1 à 2 cc d'anesthésique localement répartis entre deux à six petites injections superficielles). Pour les doigts, les extrémités ou bien chez des sujets qui ont des antécédents cardio-vasculaires, on évitera la xylocaïne adrénalinée pour utiliser uniquement la xylocaïne simple.
Pour faire la biopsie, on pince l'extrémité du fragment à prélever. On ne met pas la pince à griffes en plein milieu de ce fragment car on risque d'écraser la zone la plus intéressante à voir au microscope, d'où l'importance de pincer uniquement l'extrémité du fragment qu'on prélève et d'utiliser des pinces à petites griffes. Il faut éviter les pinces à dissection à grosses griffes.
Les bords de la biopsie sont coupés d'un trait net avec le bistouri. Si une artériole saigne en profondeur, ce qui arrive rarement pour une simple biopsie cutanée, soit on coagule par électrocoagulation, soit on ligature cette artériole avec du catgut. Un tel incident est vraiment exceptionnel.
Pour toutes les biopsies cutanées, on doit ensuite suturer les bords aseptiquement avec fil et aiguille et un nombre suffisant de points de suture pour éviter un lâchage de ces mêmes points de suture qui entraînerait une cicatrice disgracieuse (2 à 5 points de suture pour boutonnière mesurant 10 à 20 mm de long).
On met un petit pansement pour protéger la zone biopsiée, à changer tous les deux ou trois jours après nettoyage "doux" , de la cicatrice par un antiseptique usuel. Les fils sont à retirer en moyenne quinze jours après la biopsie avec une pince à disséquer et de petits ciseaux. Dans les zones qui cicatrisent mal et où risque de se développer une cicatrice hypertrophique (chéloïde) (région des oreilles, région médiosternale, épaule), on tâche de réaliser un pansement compressif pour une durée plus longue (un ou deux mois).
IV. Matériel pour réaliser une biopsie cutanée
Il s'agit d'un matériel de petite chirurgie classique, stérile, normalement contenu dans une boîte métallique, stérilisée après usage. Ce matériel est identique à celui qui sert à faire des points de sutures pour les plaies cutanées :
- bistouri : le mieux est celui à lame interchangeable,
- pinces à dissection à petites griffes : il est important d'avoir une pince à dissection avec des petites griffes pour ne pas abîmer le prélèvement au moment de l'exérèse et ne pas l'écraser,
- porte-aiguilles ordinaire pour la suture,
- fil 3 x "0" ou 5 x "0" , et aiguille courbe,
- anesthésique local : xylocaïne à 1 % adrénalinée sauf s'il s'agit d'anesthésie des extrémités (doigt, nez, orteil) et chez des sujets qui ont des antécédents de maladie cardio-vasculaire, dans ces cas, utiliser une xylocaïne simple
- seringue pour anesthésie locale, de 2 à 5 ml,
- aiguille fine mesurant de 0,5 à 0,3 mm de diamètre par exemple,
- si possible, l'opérateur aura intérêt à se procurer des gants à usage unique. Il est bon de disposer d'un petit champ opératoire et si l'on n'en possède pas, deux compresses stériles étalées de chaque côté de la zone à prélever seront aussi utiles.
La biopsie au "punch " nécessitant un matériel plus cher pour un résultat qui n'a rien de supérieur, sera avantageusement remplacée par la méthode décrite ci-dessus.
| Formol + NaCI | - formol concentré du commerce - NaCI (= sel de cuisine) - eau distillée | 100 mI 9 g 900 mI |
| Formol acide acétique | - formol concentré du commerce - acide acétique glacial du commerce - eau distillée | 100 mI 50 Mi 850 mI |
| Bouin alcoolique de Duboscq Brasil | - formol concentré du commerce - acide acétique glacial - acide picrique - alcool à 70° | 250 mI 70 mI 5 g 680 mI |
| Fixateur de Harmann-Lowy* | - formol concentré du commerce - acide acétique - chlorure de mercure - eau distillée | 100 mI 50 mI 20 g 850 mI |
- Pour ce fixateur, la partie chlorure de mercure étant toxique, on ne jette pas après usage l'ancien fixateur, mais on le stocke dans des bouteilles auxquelles on ajoute, pour un litre de fixateur usagé, 10 ml de la solution : thioacétamide 13 g, eau distillée 100 ml. On laisse un précipité se former pendant 24 heures et on filtre ce précipité que l'on stocke à part à l'état solide (lequel précipité contient les sels mercuriques résiduels qui ne doivent pas polluer).
V. Que faire du fragment biopsié ? Fixation
Il faut le mettre dans un flacon contenant des fixateurs décrits ci-dessous (5 à 20 ml de fixateur pour un fragment qui mesure 1 à 2 cm).
On a le choix entre plusieurs fixateurs.
VI. Quel fixateur choisir ?
Le "formol NaCI " est médiocre et pénètre lentement les tissus. Les chromatines et les limites cellulaires sont mal visualisées.
Le fixateur " formol-acide acétique " permet une meilleure coloration histologique.
Le "liquide Bouin alcoolique" est l'un des plus utilisés, permettant une bonne histologie.
Le " fixateur de Harmann-Lowy " donne une excellente histologie, non seulement pour les biopsies cutanées, mais pour beaucoup d'autres organes (biopsies médullaires, ganglionnaires, tumeurs, conjonctivites, etc.). Il faut se souvenir qu'avec ce fixateur mercurique, on a intérêt à recouper les pièces au bout de 5 à 10 minutes de fixation pour une pénétration plus rapide du fixateur. Les biopsies sont recoupées en fragments ne dépassant pas 2 mm d'épaisseur. Elles doivent fixer environ deux heures. On met ensuite le fragment dans de l'alcool à 70° où il pourra rester plusieurs jours sans problème et subir un transport pour être envoyé dans un laboratoire d'anatomie pathologique.
VII. I'acheminement
L'acheminement d'une biopsie vers un laboratoire se fait dans un flacon bien bouché dont on aura préalablement vérifié qu'il ne fuit pas et ne perd pas le fixateur en cours de route. Ce premier flacon est mis dans une boîte hermétique avec la fiche de renseignements cliniques correspondant au patient et envoyé dans un laboratoire d'anatomie pathologique.
Pour chaque patient est remplie une fiche de renseignements cliniques la plus détaillée possible et ne comportant pas d'erreur pour que l'examen en laboratoire soit fait dans les meilleures conditions et comportant :
- nom, prénom, date de naissance du patient,
- aspect clinique des lésions,
- zone prélevée pour la biopsie,
- diagnostic suspecté.
Ne pas hésiter à faire un petit schéma de la zone prélevée.
VIII. Techniques spéciales
Pour certaines dermatoses (maladie bulleuse, vascularite), on pourra s'adresser à un laboratoire spécialisé pour une technique d'immunofluorescence.
Pour cela, il faut mettre le fragment dans un fixateur spécial :
- sulfate d'ammonium (NH4)2 SO4 0,55 g
- tampon PBS pH 7,4 1 litre
Ce fixateur peut être conservé trois mois à 4° C au réfrigérateur.
Une fois le prélèvement fait, il faut que le fragment arrive dans les dix jours dans le laboratoire spécialisé.
Les techniques plus complexes (fixation pour la microscopie électronique, congélation d'emblée, culture de cellules, etc.) sont à décider directement avec les laboratoires susceptibles de les réaliser.
Développement et Santé, n° 129, juin 1997