L'éflornithine pour le traitement de la trypanosomose humaine africaine
I. Introduction
La trypanosomose humaine africaine (THA), communément appelée maladie du sommeil, est une parasitose affectant le système hémato-lymphatique et, dans le second stade de la maladie, le système nerveux central. Il existe 2 formes distinctes : la THA à Trypanosoma brucei gambiense, endémique en Afrique de l'ouest et centrale, et la THA à Trypanosoma brucei (T. b.) rhodesiense, endémique en Afrique de l'est et australe. Dans les deux formes, l'évolution est fatale en l'absence de traitement. En ce début de XXI' siècle, la THA à T. b. gambiense reste un problème de santé publique majeur dans certains pays d'Afrique sub-saharienne.
Le traitement du 2ème stade, ou stade méningo-encéphalitique, de la THA repose encore dans la plupart des centres de traitement sur le mélarsoprol, un dérivé arsenical utilisé depuis plus de 50 ans et toxique. Entre 2 et 10 % des patients meurent pendant ou peu après le traitement des conséquences d'une encéphalopathie aiguë dite "réactionnelle", survenant de manière imprévisible et pour laquelle aucun traitement efficace n'est disponible. De plus, le mélarsoprol a perdu de son efficacité dans plusieurs régions endémiques, avec des taux d'échecs thérapeutiques atteignant jusqu'à 30 % dans certains foyers du nord de l'Angola, du sud du Soudan et du nord-ouest de l'Ouganda.
L'éflornithine, ou DFMO (difluorométhylornithine), est la seule autre molécule enregistrée pour le traitement du 2ème stade de la THA à T. b. gambiense. Initialement développé comme anti-cancéreux, l'éflornithine a démontré une efficacité certaine in vivo sur les trypanosomes au début des années 1980. L'éflornithine est un inhibiteur irréversible de l'ornithine décarboxylase, une enzyme indispensable à la synthèse des polyamines, interférant ainsi sur la division et la différentiation cellulaire. L'action de l'éflornithine est trypanostatique et son efficacité semble donc dépendante de la réaction du système immunitaire de l'hôte. Malheureusement T.b. rhodesiense est intrinsèquement résistant à l'éflornithine.
II. Mode d'administration
L'éflornithine se présente sous la forme de flacon de 100 ml pour solution injectable. Chaque flacon contient 20 grammes d'éflornithine (200 mg/ml). Il est obligatoire de diluer l'éflornithine dans une solution normosaline (NaCI à 0.9 %) avant son administration par voie intra-veineuse. Les posologies les plus couramment utilisées sont :
- Chez l'adulte ou enfant = 12 ans 400 mg/kg/j en 4 perfusions intraveineuses lentes (2 heures) administrées toutes les 6 heures pendant 14 jours.
- Chez l'enfant < 12 ans : 600 mg/kg/j en 4 perfusions intraveineuses lentes (2 heures) administrées toutes les 6 heures pendant 14 jours.
Un dosage plus élevé chez l'enfant est justifié par une efficacité moindre du dosage journalier de 400 mg/kg/j observé dans cette catégorie d'âge, en raison de taux plasmatiques et céphalo-rachidiens plus faibles que chez l'adulte. Il est important de respecter la durée de perfusion de 2 heures afin de minimiser le risque de convulsion. Une durée de traitement de 7 jours a été démontrée moins efficace que 14 jours chez des patients en 2"' stade traités pour la première fois mais pourrait être suffisante chez des patients traités pour une rechute après traitement de mélarsoprol. Les données existantes sur l'efficacité du traitement de 7 jours ne concernant qu'un nombre limité de ces patients, il est préconisé une durée de traitement de 14 jours pour tous les patients en 2ème stade, en particulier dans les régions où la résistance de T. b. gambiense au mélarsoprol et/ou la prévalence du virus HIV sont élevées.
L'accès intraveineux prolongé dans les conditions de terrain expose les patients aux risques de phlébite, d'abcès bactérien local ou à distance ou de septicémie pouvant être fatale. Une des conditions fondamentales à l'utilisation sûre de l'éflornithine est le respect par le personnel infirmier des mesures d'asepsie lors de la pose et de l'entretien des cathéters ainsi que lors des changements de perfusions.
Les mesures généralement recommandées sont les suivantes :
- Réduction du délai entre la préparation de la perfusion d'éflornithine (respectant les règles d'asepsie) et son administration.
- Nettoyage des mains (du soignant) et de la zone d'insertion du cathéter par de l'eau et du savon.
- Environnement stérile autour du point d'insertion du cathéter : désinfection large (ex : povidone-iodine) et utilisation de compresses stériles.
- Fixation rigoureuse du cathéter par des rubans adhésifs et par une bande élastique.
- Limitation des manipulations trop proches du point d'insertion du cathéter ; l'utilisation d'un prolongateur est conseillée.
- Dilution de chaque dose unitaire d'éflornithine (100 ou 150 mg/kg) dans un soluté de perfusion normosaline de 250 ml au lieu de deux doses dans 500 ml. Cette mesure permet d'éviter l'interruption de la perfusion de plusieurs heures et ainsi le risque de contamination bactérienne du soluté de perfusion et une exposition prolongée de l'éflornithine à l'air ambiant. Chez l'enfant en bas âge, diluer l'éflornithine dans des volumes plus faibles afin d'éviter une surcharge hydrosaline : dose unitaire dans 50 ml (poids < 10 kgs) ou 100 ml (poids : 10-25 kgs).
- Utilisation d'un bouchon obturateur stérile à usage unique à visser au bout du prolongateur ou du cathéter entre chaque perfusion.
- Changement systématique du cathéter toutes les 48 heures (plus tôt si signe de phlébite).
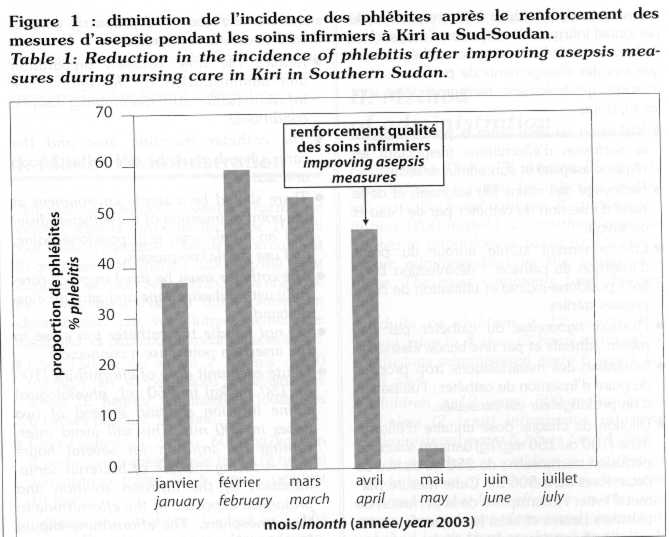
Ces mesures simples sont efficaces, comme le montre la diminution drastique de l'incidence de phlébite observée dans le centre de traitement de la THA à Kiri au Soudan après leur mise en place en avril 2003 (figure 1). Par voie orale, l'éflornithine est partiellement absorbée et s'est montrée efficace chez certains patients lors d'utilisation à titre compassionnel. Grâce à l'OMS le développement d'une forme orale est en cours. A l'heure actuelle, l'utilisation de l'éflornithine par voie orale n'est pas recommandée.
III. Efficacité
Administrée par voie intraveineuse aux posologies actuelles recommandées, l'éflornithine est un traitement très efficace associé à des taux de guérison supérieurs à 90 %, y compris chez les patients préalablement traités au mélarsoprol. Les propriétés trypanostatiques de l'éflornithine pourraient être associées à des taux de guérison plus faibles chez les patients co-infectés par le VIH.
IV. Toxicité
La mortalité intra-hospitalière des patients en 2em` stade traités par l'éflornithine est fortement abaissée par rapport au traitement au mélarsoprol. Au Sud Soudan, l'éflornithine est utilisée en traitement de 1ère ligne dans 3 programmes distincts supervisés par MSF (Comtés de Maridi, de Mundri et de Kajo-Keji) et Malteser (Comté de Yei). Plus de 2 300 patients ont été traités et la mortalité intrahospitalière dans les 3 programmes est comprise entre 0.2 et 1.4%.
Malgré ces observations encourageantes, le traitement d'éflornithine est fréquemment associé à des effets secondaires, heureusement réversibles et rarement sévères. Des effets secondaires non-spécifiques tels que fièvre, fatigue, insomnie, céphalées, douleurs articulaires et prurit sont fréquemment décrits mais sont également des symptômes habituels de la THA. Des effets secondaires plus spécifiques, le plus souvent liés aux propriétés cytotoxiques de l'éflornithine, peuvent être observés :
1. Toxicité digestive
les douleurs abdominales, les diarrhées et les vomissements sont présents chez respectivement environ 30 %, 20 % et 10 % des patients. Les diarrhées sont rarement sévères et ne nécessitent pas l'interruption du traitement.
2. Toxicité hématologique
liées aux propriétés cytostatiques de l'éflornithine et fréquemment citées dans la littérature, l'anémie, la leucopénie et la thrombopénie sont généralement discrètes à modérées et sans conséquence clinique majeure.
3. Toxicité neurologique
la survenue d'un tableau clinique correspondant à la définition d'une encéphalopathie aiguë est tout à fait exceptionnelle chez les patients traités avec l'éflornithine. La survenue de convulsions dans les premiers jours de traitement est moins rare (2-5 %) et pourrait être liée à une toxicité directe de l'éflornithine. La récupération clinique est rapide et l'interruption du traitement n'est habituellement pas nécessaire. Les céphalées sont une plainte fréquente (40-50 %) pendant le traitement mais sont également un symptôme classique de la THA. La perte d'audition est décrite mais rare (< 2%).
4. Surinfections bactériennes
Elles constituent d'après nous la complication la plus redoutable du traitement d'éflornithine. Les facteurs déclencheurs ou favorisants sont multiples : immunosuppression relative liée à la THA, possible leucopénie liée au traitement et surtout, comme déjà discuté, accès intraveineux prolongé. Il est vital de prévenir ces complications infectieuses par des soins infirmiers rigoureux (voir plus haut), de surveiller (palpation des masses musculaires et auscultation pulmonaire quotidiennes) y compris avant retour à domicile), et de traiter précocement les surinfections locales (phlébite purulente) ou à distance (pneumonies, abcès profonds des tissus mous, etc...) par une antibiothérapie intra-veineuse ou orale (ex : cloxacilline).
V. Discussion
L'éflornithine intraveineuse est actuellement le traitement le plus sûr et le plus efficace pour les patients en 2ème stade de la THA. Contrairement au mélarsoprol, la plupart des complications sévères de l'éflornithine (surinfections bactériennes) peuvent être prévenues par une prise en charge infirmière et une surveillance médicale adéquates. L'éflornithine devrait être utilisée en 1ére ligne partout où son utilisation est possible. Malheureusement, son mode d'administration compliqué (56 perfusions sur 14 jours), nécessitant un personnel infirmier suffisamment formé et nombreux ainsi que des capacités d'approvisionnement en matériels de perfusion adéquates, limite encore son utilisation.
Par ailleurs, l'éflornithine est actuellement la seule alternative thérapeutique comme traitement de 1ére ligne dans les régions où le taux de guérison obtenu avec le mélarsoprol est insuffisant, et comme traitement de 2ème ligne (rechutes après mélarsoprol) dans les autres zones endémiques. Il est donc tout à fait vital que l'accord de donation des médicaments trypanocides signé en 2001 entre Aventis et l'OMS soit prolongé au delà de 2006.
L'utilisation à large échelle de l'éflornithine en mono-thérapie pourrait à la longue conduire à la sélection de souches de T. b. gambiense résistantes à ce médicament. Les conséquences seraient dramatiques notamment dans les régions ou l'éflornithine est la seule alternative thérapeutique efficace. L'utilisation de combinaison médicamenteuse dans la THA, à l'instar du paludisme et de la tuberculose par exemple, pourrait protéger les médicaments de la survenue de résistance chez le parasite. De plus, la combinaison de l'éflornithine avec une autre molécule permettrait de raccourcir et simplifier le traitement et ainsi d'améliorer sa faisabilité et sa sécurité. L'éflornithine intra-veineuse (7 jours) combinée avec le nifurtimox, un médicament oral actif contre les trypanosomiases humaines, constitue l'association médicamenteuse la plus prometteuse. Un essai clinique mené par Epicentre et MSF évaluant cette combinaison est en cours en République du Congo.
Même utilisée en combinaison sur des durées plus courtes, l'éflornithine par voie intraveineuse n'est pas un traitement satisfaisant et le développement de nouvelles molécules, efficaces, sûres et préférablement administrées par voie orale, est une priorité urgente. La création récente d'initiatives comme le DNDi (Drugs for Neglected Diseases Initiative : www.dndi.org), qui a comme objectif de pallier au désintérêt des entreprises pharmaceutiques pour la recherche et développement de nouveaux médicaments pour les maladies parasitaires les plus négligées, est très encourageante.
Références
Legros D, Ollivier G, Gastellu-Etchegorry M, et al. Treatment of human African trypanosomiasis - present situation and needs for research and development. Lancet Infect Dis 2002; 2: 437-40.
Louis FJ, Keiser J, Simarro PP, Schmid C, Jannin J. L'éflornithine dans le traitement de la maladie du sommeil. Méd Trop 2003 ; 63(6) : 559-63.
Pépin J, Khonde N, Maiso F, Doua F, Jaffar S, Ngampo S, Mpia B, Mbulamberi D, Kuzoe F. Short-course eflornithine in Gambian trypanosomiasis: a multicentre randomized controled trial. Bull WHO 2000; 78: 1284-95.
WHO. Control and surveillance of African trypanosomiasis. Report of a WHO expert committee. WHO technical report series 881. 1998.
Développement et Santé, n°171, juin 2004