Les vaccins du futur d’intérêt pour l’Afrique
I. La dengue
La dengue est une maladie tropicale moins redoutée que le paludisme car les formes graves hémorragiques sont rares. Elle est par contre en pleine expansion, touchant plus de 110 pays, infectant 70 à 500 millions de personnes chaque année, avec 2 millions de formes graves dont environ 20 000 décès, essentiellement chez l'enfant.
Due à un arbovirus dont il existe 4 sérotypes pour les quels il n'y a pas d'immunité croisée, la dengue est transmise par un moustique du genre Aedes.
Il n'y a pas de traitement spécifique et, fait le plus préoccupant, les préventions sont en échec. En effet, en raison de l'augmentation de la résistance aux insecticides type DDT et de l'échec des larvicides organophosphorés et des adulticides, la recherche pour la mise au point d'un vaccin est devenue une priorité.
Malheureusement, de nombreux obstacles existent :
- Il n'y a pas de modèle animal de la dengue, si utile pour la mise au point d'un vaccin. Pour obtenir une protection de longue durée, il faut un vaccin vivant atténué (comme pour la rougeole).
- Le vacccin doit contenir les antigènes de 4 sérotypes pathogènes pour l'homme car il n'y a pas d'immunité croisée.
- Il semble ne pas y avoir de corrélation entre le taux des anticorps et la protection réelle.
- Enfin, la gravité de la maladie semble due à la réponse immunitaire provoquée par l'infection en effet, les chocs hypovolémiques avec hémorragie surviennent de façon retardée, quand l'organisme réagit à l'infection. Paradoxalement, les enfants dénutris, aux faibles réponses immunitaires, auraient rarement ces formes graves.
Malgré toutes ces contraintes, il semble qu'un vaccin tétravalent (après l'administration de 3 doses) ait réussi à induire des taux d'anticorps virulicides chez près de 100 % des vaccinés. Sa tolérance chez l'adulte a été acceptable.
Maintenant, les essais de phase III chez l'enfant vont permettre d'évaluer sa réelle efficacité sur le terrain, la durée de la protection et sa tolérance. On sous-estime le fardeau économique de la dengue, et il sera difficile de démontrer si le rapport coût/efficacité penchera en faveur du vaccin.
II. Vaccins contre le paludisme
Le paludisme reste un fléau majeur à l'échelon mondial, responsable de la mort de plus d'un million de personnes chaque année. Parmi les 350 à 500 millions de nouveaux cas cliniques annuels, la grande majorité des formes mortelles concerne les enfants de moins de 5 ans.
Si quatre espèces de parasites sont pathogènes pour l'homme, Plasmodium falciparum est le seul responsable des formes graves, particulièrement en Afrique.
Les premiers espoirs de vaccination contre le paludisme, annoncée il y a plus de 40 ans par Nussenzweig, ont eu d'emblée une large audience. Pourtant, aucun vaccin n'est pour l'instant disponible. Les moyens existants sont donc les médicaments et la lutte antivectorielle. Mais la situation est de plus en plus préoccupante car les parasites développent de nouvelles résistances aux médicaments, et les moustiques sont eux aussi de plus en plus résistants aux insecticides.
En 1998, un programme international appelé "Roll back Malaria" a été lancé par un consortium d'institutions prestigieuses, associant l'OMS, l'UNICEF, le PNUD et la banque mondiale, pour coordonner la lutte contre le paludisme. Le but fixé était de diminuer de moitié la mortalité et la morbidité dues au paludisme avant 2010. Il est malheureusement plus que probable que cet objectif ne sera jamais atteint.
Aussi, malgré les déconvenues des premiers essais, les vaccins sont-ils redevenus le grand espoir.
1. Pourquoi tant d'obstacles avec les vaccins antiparasitaires ?
La variabilité antigénique des parasites explique pourquoi ils échappent à la réponse immunitaire de l'hôte. Plasmodium falciparum exprime, au cours de ses mutations, plus de 5 000 antigènes qui diffèrent d'un stade parasitaire à l'autre. De plus, ces antigènes sont souvent différents d'un clone à l'autre, et pour certains au sein d'un même clone parasitaire. La mise au point de vaccins dans de telles conditions soulève des problèmes a priori majeurs, alors que beaucoup de bactéries et de vüius, antigéniyuement plus stables, induisent une immunité stérilisante.
Pourtant, l'épidémiologie du paludisme nous a appris qu'une immunité acquise existait au cours d'infections naturelles : ainsi, en zone d'endémie élevée, les anticorps transplacentaires se montrent capables de protéger les nouveau-nés pendant quelques semaines, voire quelques mois. Les expériences de transfert passif d'immunoglobulines d'adultes hyperimmuns à des enfants ont démontré leur efficacité en protégeant du moins contre les accès palustres graves.
Un vaccin qui induirait la synthèse de tels anticorps dirigés contre les antigènes des stades érythrocytaires serait prometteur.
La première démonstration d'une protection vaccinale atteignant une efficacité de près de 90 % fut réalisée par Clyde en 1973 : elle nécessitait des milliers de piqûres d'anophèles infectés par des sporozoïtes irradiés mais, en l'absence de rappel, la protection induite disparaissait en quelques mois. Depuis, des vaccins antipaludiques se sont montrés capables de protéger des animaux et des hommes contre des infections expérimentales ou naturelles en utilisant des protéines recombinantes ou des vaccins ADN. Malheureusement, la courte durée de protection n'a pas permis d'aller plus loin. Mais, depuis peu, le séquençage du génome entier de p.falciparum et de P. vivax facilite l'isolement d'antigènes vaccinants et la compréhension de la pathogénicité.
2. Les candidats vaccins en 2009
Avec une vingtaine d'antigènes considérés comme les plus immunogènes, plus d'une centaine de vac¬cins sont actuellement étudiés.
On distingue les vaccins agissant au stade préérythrocytaire, au stade sanguin asexué et enfin ceux bloquant la transmission du parasite.
a) Vaccins antipaludiques contre les stades pré-érythrocytaires
Les vaccins pré-érythrocytaires doivent induire une réponse immune contre les sporozoïtes ou les schizontes hépatiques pour bloquer toute libération de schizontes dans le sang. Pour induire une immunité chez les sujets non immuns, comme les touristes, l'efficacité de ce type de vaccin doit être de 100 %. Sans cela, il ne pourrait retarder que de quelques heures à quelques jours la survenue d'un accès palustre. Un des intérêts majeurs des antigènes pré-érythrocytaires est qu'ils se sont révélés moins variables génétiquement que les autres antigènes de Plasmodium.
Les premiers vaccins de ce type ont essayé de reproduire l'immunité induite par l'injection de sporozoïtes irradiés, c'est-à-dire l'apparition d'anticorps anti CSP (Circum sporozoïte protein). La protéine de surface LSA 3(Liver stage antigen) a été identifiée comme étant très antigénique chez le chimpanzé et des essais de phase I et II sont en cours.
Mais c'est incontestablement le complexe RTS, S/AS02A (GSK) composé de particules protéiques comprenant 19 copies de la portion centrale de la CSP et d'une partie terminale de sa région carboxyterminale fusionnée à l'antigène S du virus de l'hépatite B et d'un adjuvant complexe, l'AS02A, qui vient de donner des résultats prometteurs. Son étude a utilisé pour comparateur le vaccin antira-bique.
En effet, il a permis de protéger 48 % des volontaires infectés expérimentalement Ensuite, en Gambie, sur une période de 15 semaines, les nouvelles infections ont diminué de 34 (%. Enfin, chez l'enfant, au Mozambique, ce vaccin a réduit de 45 % le risque de nouvelle infection et de 30 % celui d'accès palustre pendant 6 mois. Quant aux formes graves, elles ont elles aussi diminué de 57 %. Les derniers résultats confirment l'efficacité de ce vaccin contre les formes graves de l'enfant. Aussi des essais de Phase III à grande échelle sont-ils en cours.
En conclusion :
Si l'effet protecteur de ce vaccin est incontestable, celui-ci est de faible durée, ce qui représente un obstacle majeur à sa mise sur le marché.
b) Vaccins antipaludiques contre les stades sanguins asexués
Ces vaccins ont pour but d'empêcher l'invasion des hématies et donc de contrôler les densités plasmodiales circulantes, ce qui aurait le mérite d'éviter les formes cliniques graves.
La molécule MSP3 (merozoïte surface protein) exprimée en surface de la membrane parasitaire joue un'r81e primordial. En effet, des études immuno-épidémiologiques récentes ont démontré que, chez le sujet ayant une infection chronique, la majorité des anticorps protecteurs sont de type IgG 3 anti MSP3. Au Sénégal, chez l'enfant, il existe une corrélation directe entre le taux d'anticorps et la rareté de paludismes graves (neuropaludisme en particulier). In vitro, ces mêmes IgG 3 sont capables de provoquer une lyse parasitaire. Des essais d'immunisation chez les primates ont donné des résultats en encourageants. Les phases I et II sont en cours chez l'homme.
D'autres antigènes parasitaires sont impliqués dans la physiopathologie du paludisme, par exemple le GPI (glycosyl phosphatidil inositol) responsable de la libération de médiateurs pro-inflammatoires lors de la rupture des schizontes. Parmi les autres candidats vaccins pour lesquels des essais sont en cours, MSP I(meirozoïte surface protein 1) et surtout FMP 2 AMA 1(atypical membrane ctntigen 1). Ce candidat vaccin induit un taux d'anticorps anti-AMA1 cent fois supérieur aux taux initiaux, ce qui laisse espérer une protection clinique impor-tante. Mais il est trop tôt pour savoir si l'immtmité induite est plus durable. Curieusement, certains antigènes tels que MSP1 donnent de très bons résultats chez le primate alors qu'ils sont décevants chez l'homme.
Enfin, différents essais, combinant plusieurs antigènes tels que MSPII + RES A semblent donner de bons résultats dans la prévention des paludismes graves.
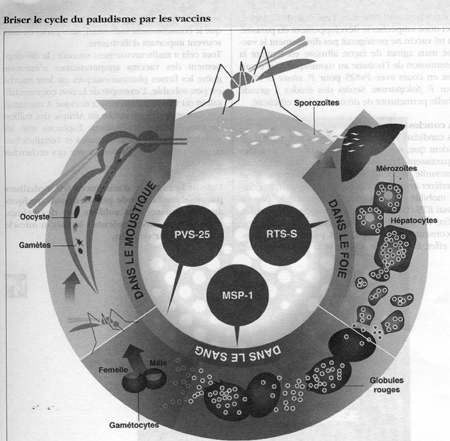
c) Vaccins antipaludiques bloquant la transmission
On conçoit que des anticorps agissant contre les antigènes de surface des stades sexués pourraient bloquer la fécondation dans l'estomac de l'anophèle et donc empêcher le développement du parasite. Un tel vaccin ne protégerait pas directement le vacciné mais agirait de façon altruiste en limitant la transmission de l'homme au moustique. Des essais sont en cours avec PvS25 pour P. vivax et PfS25 pour P. falciparum. Seules des études à grande échelle permettront de démontrer leur efficacité.
En conclusion
Les candidats vaccins ne manquent pas, mais il est évident que, sur le terrain, de nombreux obstacles apparaissent. D'abord, en zone de forte endémie, l'immunité partielle naturellement acquise peut interférer avec la vaccination. D'autre part, la grande mobilité de la population, comme le prouve l'essai RTS (GSK), peut rendre impossible un suivi. Enfin, les bonnes pratiques cliniques, telles que le consentement éclairé, sont parfois inadaptées. En effet, la structure sociale et la culture rendent le consentement communautaire aussi important que le consentement individuel, sans parler du taux souvent important d'illettrisme. Tout cela a malheureusement un coût ; le développement des vaccins antiparasitaires n'intéresse guère les firmes pharmaceutiques car leur marché est peu solvable. L'exemple de la non commercialisation du vaccin antiméningococcique A conjugué, qui sauverait chaque année en Afrique des milliers de vies, est aussi révoltant. Espérons que les grandes instances internationales et certaines fon-dations privées permettront à ces ces recherches d'aboutir.
Devant le nombre d'annonces triomphalistes parues dans la grande presse depuis quelques années, qui se sont soldées par des échecs, nous devons être prudents : le vaccin miracle n'est pas pour demain.
Développement et Santé, n°195, 2009