Paludisme et grossesse
I. Généralités
Le paludisme est de très loin l’affection tropicale la plus répandue, puisque environ un milliard de personnes vivent en zone à risques. Chaque année, il y a environ 300 millions de malades, dont 1 à 2 millions décèdent, principalement des enfants. Avec l’apparition et la rapide extension des chimiorésistances et de l’accoutumance des moustiques aux insecticides, le paludisme est actuellement en progression.
| Le paludisme est dû à un parasite sanguin, le Plasmodium, transmis par un moustique, l’anophèle femelle. |  Anophèle |
Après multiplication dans les hépatocytes, le protozoaire passe dans la circulation et se multiplie dans les hématies. L’envahissement, puis l’éclatement des globules rouges parasités, provoquent les accès palustres cycliques. Il existe plusieurs espèces de Plasmodium, avec des caractéristiques différentes (Tableau I).
| Espèce | Répartition | Rythme des accès | Gravité | Complications | Longévité |
|---|---|---|---|---|---|
| P. falciparum | Toutes les zones tropicales | Fièvre tierce | Maligne | Accès pernicieux mortel Paludisme viscéral évolutif | 2 mois |
| P. vivax | Amérique du sud, Asie, Afrique du nord | Fièvre tierce | Bénigne | Asthénie, anémie | 3 ans |
| P. ovale | Afrique centrale | Fièvre tierce | Bénigne | Asthénie, anémie | 5 ans |
| P. malariae | Zones tropicales (mais rares) | Fièvre quarte | Bénigne | Sybdrome néphrotique | 20 ans |
La crise typique
La phase d’invasion survient chez les sujets sans prémunition. Elle est marquée par un embarras gastrique fébrile. La fièvre est en plateau et peut faire égarer le diagnostic vers une autre pathologie (typhoïde).
Puis, survient la crise typique de paludisme, se répétant toutes les 48 ou 72 heures, réalisant les accès fébriles tierces ou quarte. Apparaît tout d’abord une sensation de froid avec des frissons incontrôlables, puis la fièvre monte à 40°C, la peau du patient est sèche et brûlante. Enfin le malade se couvre de sueurs abondantes. L’ensemble de ces phénomènes dure quelques heures. Puis l’état général du sujet s’améliore très nettement jusqu’à l’accès suivant.
En raison de la présence d’hypnozoïtes hépatiques, des reviviscences sont possibles pendant 3 à 5 ans pour P. vivax et P. ovale. Les hypnozoïtes n’existent ni avec P. falciparum, ni avec P. malariae. Pour cette dernière espèce, les résurgences très tardives (10 ans) seraient dues à des formes érythrocytaires latentes.
L’accès pernicieux ou neuropaludisme
Dû exclusivement à Plasmodium falciparum, il réalise une encéphalopathie aiguë. Il peut survenir brutalement, sans signe prémonitoire ou succéder à un accès typique négligé. La fièvre dépasse 40°C, une hypothermie étant de mauvais pronostic (Tableau II). Des convulsions sont fréquentes et le patient sombre dans le coma. Le diagnostic doit être rapidement posé et le traitement par quinine intraveineuse mis en route d’urgence, l’évolution spontanée étant fréquemment mortelle.
| Cliniques | Biologiques |
|---|---|
| Prostration, coma Convulsions généralisées Collapsus cardio-vasculaire Syndrome hémorragique Oedème pulmonaire Ictère | Hypoglycémie < 2,2 mmol/L Anémie grave (< 6 g/dL) Oligurie (< 400 ml/j) Créatininémie < 265 µmol/L Hémoglobinurie Acidose sanguine (pH < 7.25) |
Le paludisme viscéral évolutif
Il survient, en zone d’endémie chez des individus, insuffisamment prémunis et soumis à des inoculations massives. Les troubles associent pâleur, splénomégalie et fièvre à 39°C. L’examen de sang confirme l’anémie hémolytique et retrouve les Plasmodiums. Le traitement spécifique fait disparaître les troubles. La fièvre bilieuse hémoglobinurique est devenue exceptionnelle. En effet, il s’agit d’une hémolyse aiguë, réaction anaphylactique à la prise de quinine, chez un sujet ayant déjà, un certain temps auparavant, pris de la quinine pour un paludisme.
II. Diagnostic et traitement
Le diagnostic repose sur la mise en évidence de l’hématozoaire sur le frottis sanguin, permettant l’identification du Plasmodium et sa quantification. Le test rapide (Now-malaria®) permet d’affirmer rapidement la présence de Plasmodium falciparum. Il doit être recherché chez la mère, et en cas d’accouchement d’une mère atteinte de paludisme, au niveau du placenta et chez l’enfant. Le sérodiagnostic n’est pas utile au diagnostic d’urgence. Mais il est indiqué pour le diagnostic rétrospectif d’une fièvre, pour les enquêtes épidémiologiques et enfin pour éliminer les donneurs de sang paludéens.
Le traitement habituel repose sur la quinine ou l'association proguanil/atovaquone pour P. falciparum et sur la chloroquine pour les autres espèces. D’autres produits sont utilisables dans certaines circonstances : quinine, méfloquine, halofantrine (après ECG). De nouveaux antipaludiques sont à l’étude, comme le quinghaosu, extrait d’une plante, l’artémisinine, qui est assez efficace, mais s’est révélé tératogène.
III. Paludisme et grossesse
Le paludisme et la grossesse sont deux situations qui s’aggravent mutuellement. En effet, le paludisme est plus grave et plus fréquent au cours de la grossesse, provoquant une importante morbidité et mortalité maternelle, fœtale et périnatale.
Les effets du paludisme sont très variables selon le taux d’immunité du sujet. En effet, les stimulations antigéniques répétées dues aux piqûres continuelles de moustiques entraînent un certain degré d’immunité due au IgG, ayant une spécificité pour des antigènes variants de surface. Aussi les conséquences seront-elles différentes selon qu’il s’agit d’une femme immunisée ou non.
Femme vivant en zone d’endémie
La grossesse s’accompagne d’une certaine diminution de l’immunité acquise, surtout chez la primigeste, entraînant donc une augmentation de la fréquence et de l’intensité de la parasitémie. En échange, le taux des anticorps est un peu modifié. Il est possible que les besoins élevés en protéines, associés à une carence nutritionnelle, expliquent une insuffisance de production des gammaglobulines.
La première grossesse réactive plus le paludisme que les grossesses ultérieures et le paludisme est plus fréquent et plus grave chez les primigestes et leurs nouveaux-nés. En effet l’utérus et le placenta forment une nouvelle localisation pour les parasites. Il est très probable que cela induise une réponse locale, apportant une certaine protection contre les infestations ultérieures. La parasitémie diminue avec la parité et l’âge de la mère, de risque 9 chez les primigestes au risque 2 à la sixième grossesse.
En outre, au cours de la grossesse, la prévalence et l’intensité du paludisme augmentent dans les premières semaines pour revenir à un taux équivalent à celui de la population environnante dans les dernières semaines. Une étude réalisée en Gambie montre nettement la prépondérance du paludisme chez les primipares, en brousse avec un maximum au 2ème trimestre (Tableau III). Le fœtus est en général protégé par les anticorps maternels, expliquant le taux relativement faible de paludisme congénital (0,5%).
| 1è pare | 2è pare | 3è pare | |
| Village de Keneba : Pourcentage de femmes infectées Parasitémie (moyenne géométrique) | 64 332 | 39 120 | 21 63 |
| Ville Brousse | 10 26 | 8 16 | |
| 1er trimestre 2è trimestre 3è trimestre | 55 75 50 | 33 46 40 | 25 17 20 |
Chez la femme non immunisée (touriste) ayant fait un séjour en zone tropicale, toutes les formes de paludisme peuvent se rencontrer, allant des formes bénignes à l’accès pernicieux.
Les accès fébriles peuvent provoquer un avortement au début ou un accouchement prématuré en fin de grossesse. C’est essentiellement en cas de paludisme contracté en fin de grossesse que peut survenir une infestation du fœtus à l’origine du paludisme congénital (10 % dans ce cas). En l’absence de diagnostic et de traitement rapide, le pronostic est réservé pour la mère et le fœtus, l’évolution pouvant être rapidement fatale.
Retentissement de la grossesse sur le paludisme
La grossesse, véritable « stress » immunologique, provoque une chute de l’immunité anti-palustre et, de ce fait, peut démasquer un paludisme latent, ou favoriser la survenue de formes graves (accès pernicieux). Le taux d’infestation du placenta est toujours supérieur à celui du sang.
En effet, le Plasmodium est souvent retrouvé dans le placenta, alors que les examens de sang restent négatifs. Ainsi, à Panama, sur 400 placentas examinés, 11 étaient parasités, alors que les frottis des mêmes patients étaient négatifs. Il en a été de même à Dakar, où, sur 130 placentas, 15 % étaient positifs contre seulement 1,6% des sangs de fœtus.
Les conséquences sont différentes selon le taux d’endémicité paludéenne de la région considérée. En zone d’hyperendémie, l’immunité est solide et les manifestations pathologiques sont donc rares. En zone d’hypoendémie, l’immunité est précaire et le risque de contracter un paludisme patent est assez élevé chez la femme enceinte.
Les symptômes classiques du paludisme sont accentués. Quel que soit le stade de la grossesse, Plasmodium falciparum risque toujours d’évoluer, sans traitement, vers l’accès pernicieux. En fin de grossesse, il y a souvent un risque de reviviscence et il n’est pas rare de constater, lors d’une crise aiguë de paludisme, un accouchement prématuré avec parfois mort subite de la mère dans les suites immédiates.
La découverte de l’hématozoaire est inconstante, en zone d’endémie où l’autotraitement, particulièrement fréquent, suffit à masquer le diagnostic. Les auteurs sont divisés sur l’existence d’une corrélation possible entre le taux d’anticorps anti-palustres et l’âge de la grossesse, mais s’accordent pour dire que le paludisme est la principale cause d’anémie au cours de la grossesse. Cette anémie apparaît vers la 20ème semaine. Elle est hémolytique, normocytaire et normochrome, surtout importante chez les primigestes, et s’aggrave parallèlement aux nombres d’accès de paludisme. L’anémie sévère augmente la mortalité maternelle et fœtale. Aussi, l’importance d’une chimioprophylaxie correcte est-elle démontrée par la disparition des anémies hémolytiques dans ce cas.
Les formes graves sont rares et semblent plus fréquentes en fin de grossesse. L’accès pernicieux entraîne une mortalité maternelle élevée et une mort fœtale in utero quasiment constante. La mise sous quinine intraveineuse s’impose. L’insuffisance rénale aiguë est une complication rare mais grave, au voisinage du terme. Le déclenchement de l’accouchement doit être rapide, car cela facilite la reprise de la diurèse.
Retentissement du paludisme sur la grossesse
Il est certain qu’un paludisme transforme une grossesse normale en grossesse pathologique. Les accès répétés de paludisme peuvent perturber le fonctionnement hypophysaire et entraîner une stérilité. Par ailleurs, la nidation peut être perturbée chez les femmes atteintes de paludisme viscéral évolutif, avec une splénomégalie importante.
Au début, le paludisme entraîne une accentuation des « signes sympathiques » de la grossesse. Dans les grossesses avancées, il existe une corrélation entre le taux de parasitémie et la durée de la fièvre d’une part et le risque d’avortement d’autre part, surtout en zone endémique. La mort fœtale in utero, l’accouchement prématuré et l’hypotrophie fœtale sont plus fréquents.
Le placenta est un important réservoir de parasites, même sans parasitémie décelable. Les lésions placentaires à type de réponse inflammatoire et hormonale sont plus fréquentes chez la primipare. Les placentas de mères impaludées ont habituellement un poids plus faible que les placentas sains. L’étude microscopique a montré un épaississement de la membrane basale du trophoblaste, une infiltration inflammatoire intervilleuse importante une dégénérescence hyaline des villosités des foyers de nécrose syncytiale et la présence très fréquente de pigment malarique dans les espaces intervilleux. Enfin, il a été montré récemment une capacité particulière de cytoadhérence des hématies infestées à la couche de syncytiotrophoblastes du placenta par le récepteur chondroïtine sulfate A, ce qui provoque une séquestration des parasites dans le placenta (figure 1).
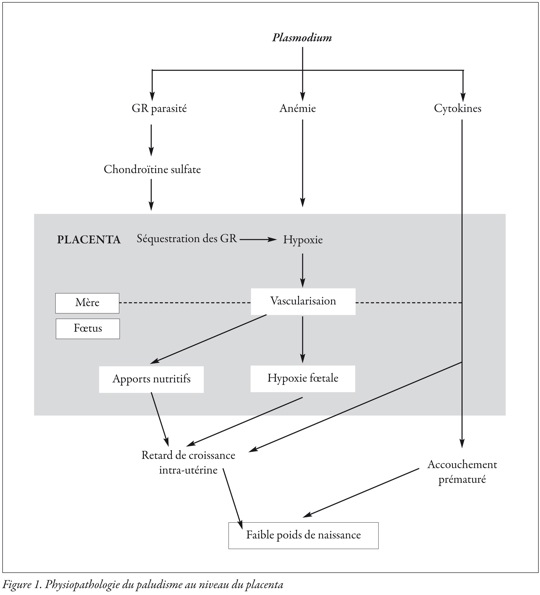
A l’approche du terme, le paludisme est un facteur important de prématurité, surtout chez la primigeste. Les dystocies dynamiques sont fréquentes et probablement liées à une hypoxie utérine. Il faut rester très vigilant et prévenir toute hémorragie de la délivrance ou du post-partum, qui risquerait d’être mal tolérée, chez une femme déjà anémiée.
Dans le post-partum, le paludisme peut évoquer une fièvre purpérale. Aussi, en l’absence de diagnostic précis, en zone d’endémie, est-il conseillé d’associer antibiotiques et antipaludiques.
Un accès pernicieux doit être distingué d’une éclampsie (Tableau IV), bien que ces deux affections puissent être associées. La parasitémie est alors importante, due à la libération d’hématozoaires par spléno-contraction. Le pronostic est assez sombre.
| Eclampsie | Accès pernicieux |
|---|---|
| Hypertension artérielle Prise de poids Oedèmes des membres inférieurs Coma Crises convulsives itératives Albuminurie | Antécédents de paludisme Fièvre Hépatosplénomégalie Coma calme Crises convulsives rares Anémie hémolytique Diagnostic : frottis sanguin |
Avec l’apparition du sida dans les pays tropicaux, s’est posée la question de l’aggravation des affections parasitaires chez les personnes infectées par le VIH. Après des études contradictoires, il semble actuellement établi que les femmes infectées par le VIH présentent une élévation de la prévalence et de la parasitémie par P. falciparum. En revanche, l’aggravation de l’infestation par le VIH n’a pas été démontrée en cas de coinfection avec le paludisme.
Le paludisme de la mère retentit bien évidemment sur le fœtus. Une fois le risque d’avortement ou d’accouchement prématuré écarté, le fœtus naît avec un poids plus faible que le fœtus né de mère saine (Tableau V), avec un risque de mortalité dans 6% des cas.
| Pays | Nombre de naissances | Poids moyen (en grammes) des nouveau-nés Parasités Sains | |
|---|---|---|---|
| Côte d'Ivoire | 198 | 2 960 | 3 080 |
| Ghana | 50 | 2 855 | 3 033 |
| Nigeria | 440 | 2 778 | 3 076 |
| Ouganda | 570 | 2 805 | 3 068 |
| Tanzanie | 413 | 2 945 | 3 020 |
Le risque de paludisme congénital est certain et il est plus fréquent en zone d’hypoendémie du fait d’une faible immunisation maternelle. Le mécanisme du passage transplacentaire des hématies parasitées est mal élucidé : parasite migrant à l’état libre ou dans une hématie infestée, nécessité d’un placenta pathologique, passage au moment des pics fébriles ? De toute façon, on estime que la densité parasitaire reste 300 à 1 000 fois plus faible chez le fœtus que chez la mère. Par ailleurs, il n’y a pas de phase exo-érythrocytaire, étant donné l’absence d’inoculation transcutanée par un moustique.
Le paludisme congénital est affirmé sur l’élimination de toutes les possibilités de contamination directe (transfusion, inoculation naturelle par le moustique), et l’identité du Plasmodium chez la mère et l’enfant, retrouvé dans le sang du cordon à la naissance. Une double infestation fœtale (P. vivax et P. malariae) a déjà été rapportée, de même qu’une infestation par P. falciparum chez des jumeaux, ayant entraîné une anémie.
Le paludisme congénital-infestation se caractérise par la présence isolée d’hématozaires dans le sang. Cette parasitémie, asymptomatique, est spontanément régressive. Le paludisme congénital-maladie est l’association d’une parasitémie et de symptômes cliniques. Le paludisme périnatal est acquis au moment de la naissance (traumatisme obstétrical). Il nécessite donc une incubation identique à l’incubation habituelle de l’espèce plasmodiale en cause.
Les troubles cliniques du paludisme congénital peuvent apparaître plusieurs mois après la naissance : hépato-splénomégalie, ictère, pâleur et anémie hémolytique. Un retard de croissance pondérale est souvent retrouvé. Le pronostic est favorable sous traitement rapide.
Une certaine hypogalactie est constatée chez les mères paludéennes, mais cela ne contre-indique pas l’allaitement maternel. Les antipaludiques (chloroquine, quinine) passent dans le lait mais en quantité infime, sans aucune conséquence pour le nouveau-né. Par ailleurs, le lait maternel est pauvre en acide para-aminobenzoïque, substance indispensable au métabolisme du Plasmodium. Dans les trois premiers mois de la vie, les IgG de la mère transmises à l’enfant sont protectrices. La présence d’hémoglobine fœtale est un facteur supplémentaire, expliquant l’absence habituelle de paludisme chez les nouveau-nés de mères vivant en zone d’endémie.
Traitement et prophylaxie
Le traitement classique de la primo-invasion et de l’accès simple dus à P. vivax, P. ovale et P. malariae repose sur la chloroquine, à raison de 9 comprimés à 100 mg à J1 (6 comp + 3 comp 6 heures plus tard) et 300 mg à J2 et J3. Ce traitement pourra être repris quelques mois plus tard, en cas de reviviscence.
En cas d’accès pernicieux, le traitement doit être instauré d’urgence : quinine 1,5 g à 2 g en perfusion lente par voie intraveineuse pendant 3 à 5 jours. La chloroquine et la quinine ne sont ni abortives, ni tératogènes. Mais la quinine peut augmenter les contractions d’un utérus manifestant déjà une tendance contractile prématurée.
S’il s’agit d’une souche de P. falciparum chloroquino-résistante, cas devenu le plus fréquent, on traite par la quinine, l’association atovaquone-proguanil, éventuellement par l’halofantrine ou encore par méfloquine, mais ce dernier produit peut provoquer des effets secondaires non négligeables à type de troubles digestifs ou même neuropsychiques mais n’a pas d’effet abortif ni tératogène. L’association artésunate-atovaquone-proguanil s’est avérée efficace et bien tolérée. En cas de paludisme congénital, il faut traiter l’enfant dès la naissance, soit par chloroquine (en sirop) : 100 mg/j pendant 2 jours, puis 50 mg/j pendant 3 jours, puis 1 cuillère-mesure (soit 25 mg) 1 jour sur 2 pendant 2 mois, soit par la quinine IV ou IM (25 mg/kg/j) pendant 3 jours.
La prophylaxie est fondamentale chez la femme enceinte, plus sensible que d’autres au paludisme, et qui « attire » plus les moustiques que la femme non enceinte (élévation de la chaleur cutanée et sécrétion de substances volatiles).
Eviter les piqûres de moustiques nécessite de revêtir des vêtements légers, mais longs et de dormir sous une moustiquaire si possible imprégnée d’insecticide, les moustiques piquant essentiellement entre 22h et 2h du matin. Cette moustiquaire ne présente aucun danger pour les dormeurs, y compris les très jeunes enfants. On peut y adjoindre avec prudence l’application de répellents sur la peau (type Mousticrême, Moustifluid, Moustidose ou encore Insect-écran adulte et Insect-écran enfant), de pastilles ou spirales auto-combustibles de pyréthrinoïdes. L’application de produits insecticides sur les habits (Insect-écran, Moustidose) est souvent une précaution utile. L’usage du DDT, ayant provoqué des retards au développement neurologique du fœtus, n’est plus utilisé.
La chimioprophylaxie est indispensable par chloroquine, proguanil-chloroquine ou proguanil-atovarone, et doit être adaptée à la zone où se rend la femme enceinte avec parfois des effets secondaires comme du prurit ou des troubles digestifs. En effet, l’OMS a divisé les pays tropicaux en 3 zones selon l’intensité de la résistance (Tableau VI).
| Zone I : Caraïbes Zone II : Afrique de l'ouest Zone III : Asie, Amérique du sud, Afrique de l'est et centrale | Chloroquine Proguanil-chloroquine Proguanil-atovaquone Proguanil-chloroquine |
En fait, ce tableau malgré ses mises à jour, est perpétuellement en retard sur l’aggravation de la chloroquino-résistance, qui a gagné maintenant l’ensemble du monde tropical. De plus, les intolérances à la méfloquine entrainent une certaine prudence vis-à-vis de ce produit. Ces produits ne sont ni abortifs ni tératogènes. Aussi, l’OMS préconise-t-elle actuellement le traitement préventif intermittent par sulfadoxine-pyriméthamine, à raison de seulement 4 prises au cours de la grossesse. Ceci permet de réduire nettement l’incidence du paludisme lors des grossesses, incidence qui passe, par exemple au Congo, de 35 % à 19,7 %.
La vaccination est encore à l’étude. Elle est complexe, car le parasite se modifie sans cesse au niveau de son circuit dans l’organisme. Aussi le vaccin est-il orienté contre trois stades parasitaires : sporozoïtes, mérozoïtes et gamétocytes et les essais actuels sont encourageants.
| Ce qui est nouveau |
|---|
|
| En pratique |
|---|
|