Les vaccins du paludisme
Les vaccins du paludisme
par Jacques Le Bras
Service de parasitologie, Université René-Descartes et Hôpital Bichat-Claude-Bernard, Paris.
Les premiers espoirs de vaccination du paludisme, annoncés il y a 32 ans (Nussenzweig, 1967) ont eu d'emblée une large audience. L'intérêt du grand public pour ce vaccin avait diverses raisons. La faillite du projet d'éradication du paludisme venait d'être annoncée, la chloroquinorésistance essaimait en Asie et en Amérique du Sud et le paludisme des réfugiés du Sud-Est asiatique ajoutait sa mortalité à celle des guerres régionales. Cet intérêt du public pour le vaccin du paludisme ne s'est pas démenti depuis, bien que toutes les déclarations de succès soient apparues prématurées sinon intempestives. Le défi posé aux immunologistes par la complexité des phénomènes d'échappement des parasites aux réponses immunitaires a amplifié régulièrement le nombre de chercheurs impliqués dans la vaccination antipaludique, grâce à un niveau élevé de financements dans les pays industrialisés. Chaque avancée fondamentale a souvent été présentée par les chercheurs comme ayant une perspective d'application à court terme. Le manque de critères robustes d'évaluation d'un vaccin antipaludique explique sans doute la confusion des médias et du public.
Compte tenu de l'absence d'immunité stérilisante dans le paludisme, un vaccin d'action prolongée. utilisable contre toutes les variétés de Plasmodium falciparum est-il envisageable ?
I. Les cibles vaccinales (tableau n° 1)
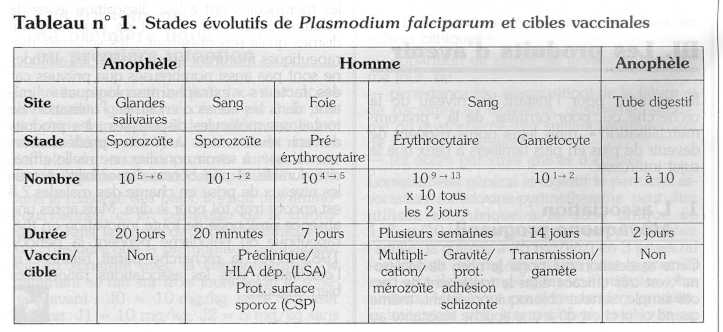
1. Vaccins antisporozoïtaires
L'immunisation de souris, puis d'hommes, avec des sporozoïtes irradiés induit une protection complète contre une inoculation ultérieure avec des sporozoïtes de la même souche plasmodiale. Ces essais n'ont pas eu d'application pratique, les parasites ne pouvant pas être produits à un coût acceptable.
Une protéine couvrant toute la surface du sporozoïte (CSP), est constituée de répétitions de 4 acides aminés (NANP). Son analogue de synthèse induit une production d'anticorps partiellement protectrice. D'autres peptides dérivés du sporozoïte (CS protéines) produisent une réponse cellulaire cytotoxique pour le stade infestant mais ils présentent un polymorphisme qui modifie leur présentation antigénique par le complexe majeur d'histocompatibilité (CMH) de façon imprévisible. Il est possible de mêler des CS protéines différentes capables d'induire à la fois une réponse anticorps et une réponse cellulaire.
2. Vaccin contre les stades pré-érythrocytaires
Un antigène spécifique du stade hépatique, LSA-1, est présenté aux lymphocytes T cytolytiques par certains types HLA comme HLAB53. Cette cible a été identifiée par immunogénétique " inverse ", l'observation d'une meilleure protection contre le paludisme des sujets HLA-B53 et All ayant abouti à identifier les antigènes se fixant sur les molécules HLA de classe 1.
3. Vaccin contre les stades érythrocytaires asexués
Les mérozoïtes, en entrant dans le globule rouge, expriment des antigènes à sa surface comme Pf EMP1, hélas très variables. Certaines parties des antigènes variables de la surface du mérozoÏte (MSP) ou produits par le jeune trophozoïte en anneau (RESA), sont conservées dans la plupart des souches de Plasmodium. Ces peptides ont été retenus pour préparer un vaccin ayant pour but de bloquer le cycle érythrocytaire.
D'autres antigènes, encore mal identifiés, semblent participer aux phénomènes toxiques (comme l'excès de production de TNF-alpha) qui sont à l'origine de l'accès pernicieux. Un vaccin les utilisant pourrait empêcher l'évolution vers l'accès pernicieux de l'infection par P. falciparum.
C'est un polymère d'unités de 45 acides aminés dérivés de 3 protéines des stades étythrocytaires qui constitue le premier vaccin ayant fait l'objet d'une étude d'efficacité : SPf 66, développé en Colombie (Pattaroyo, 1988).
4. Vaccins antigamétocytaires
Un vaccin peut entraîner la formation d'anticorps contre les gamétocytes dans le but de bloquer la transmission à l'anophèle. Le premier d'entre eux, Pfs-25, est inefficace dans un modèle où l'anophèle se nourrit sur un échantillon de sang au travers d'une membrane.
Il. Les contraintes techniques
Depuis les années 1980, les techniques des anticorps monoclonaux et de biologie moléculaire ont permis d'identifier, de localiser et de produire les protéines antigéniques et d'identifier leurs gènes. Entre 1987 et 1997, le nombre de protéines antigéniques dont les gènes étaient séquences est passé de 27 à 3 200. Dans le même temps, aucune technique robuste et reproductible de mesure de l'effet protecteur n'a pu être proposée par les immunologistes. Les taux d'anticorps et les réponses des différentes classes de cellules immunitaires mesurées in vitro ne sont pas en corrélation avec la protection.
Les essais cliniques, plus récents, n'ont pas encore abouti à des protocoles suffisamment standardisés pour que la comparaison de ces essais soit réalisable.
III. Vaccins multivalents et nouvelles technologies
1. Adjuvants
L'alun (alumine) est l'adjuvant classique le plus utilisé. Un virus de la vaccine atténué et modifié pour inclure des antigènes plasmodiaux qui pourraient constituer un vaccin peu coûteux et efficace, est en étude, cette primovaccination pourrait être complétée par un rappel utilisant des peptides de synthèse. L'insertion de peptides immunogènes plasmodiaux dans la protéine de surface du virus de l'hépatite B a récemment montré sa faisabilité, avec 6 volontaires sur 7 protégés contre une inoculation anophélienne homologue.
2. Multi-épitopes
Il est possible de constituer un peptide de synthèse en arborescence présentant des épitopes antigéniques multiples (MAP). Si elles sont utilisées avec un adjuvant puissant, ces constructions peuvent surmonter la restriction génétique HLA qui limite la production d'anticorps.
3. Vaccin d'ADN nu
Des résultats préliminaires montrent qu'un plasmide d'ADN codant divers gènes plasmodiaux peut accéder à une cellule animale pour y produire ses protéines. La stimulation de l'immunité cellulaire T obtenue serait plus efficace et il serait possible de constituer ainsi un vaccin largement multivalent en une seule injection.
IV. Conclusion
Les immunologistes ont validé de nombreuses approches vaccinales innovantes applicables au paludisme qui montrent qu'un vaccin multi-antigènes et multistades est capable, expérimentalement et chez des volontaires (phase III), de produire une réponse protectrice polyvalente et non spécifique d'une souche. Les phases d'évaluation clinique (phase III) ont un coût très élevé. L'industrie, soutenue par des grands organismes de financement de programmes sanitaires civils et militaires, assume ces programmes à risque élevé d'échec. Une difficulté est le choix d'une technologie et des molécules vaccinales parmi les innombrables possibilités désormais disponibles. Une autre difficulté est la complexité de l'épidémiologie du paludisme et l'absence critique d'un consensus sur les méthodes d'évaluation d'un vaccin antipaludique.
Développement et Santé, n° 138, décembre 1998