L'ulcère de Buruli
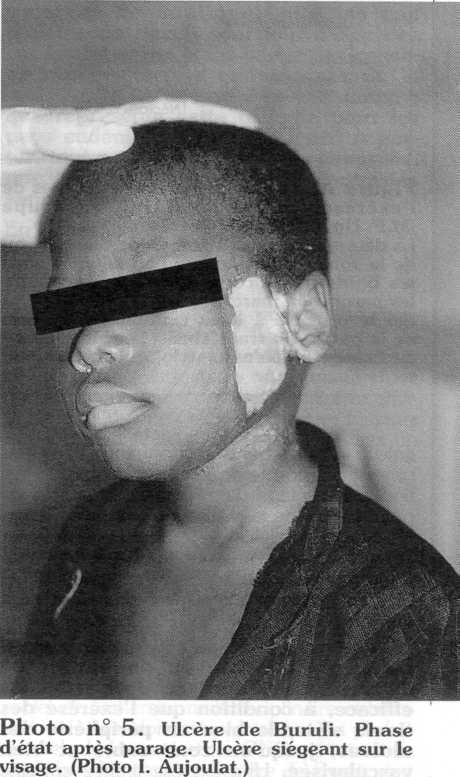
L'ulcère de Buruli est une mycobactériose due au Mycobacterium ulcerans qui provoque de vastes ulcérations cutanées survenant par nécrose de la graisse hypodermique, causée par la production d'une exotoxine. Les enfants sont la cible privilégiée de cette maladie. Les membres surtout sont touchés, mais toutes les parties du corps peuvent être atteintes, en particulier le tronc et le visage. L'environnement semble constituer la source de cette infection, mais le bacille n'en a jamais été isolé jusqu'à présent [1, 2]. La transmission du M. ulcerans à l'homme pourrait s'effectuer à la suite de microtraumatismes cutanés. On décrit habituellement trois phases dans l'évolution de la maladie : une phase de début (stade pré-ulcératif qui peut revêtir deux formes (nodulaire ou oedémateuse), une phase d'état avec des lésions se caractérisant par l'aspect décollé des berges de l'ulcère, enfin une phase de cicatrisation, souvent accompagnée de complications qui entraînent un handicap irréversible (cicatrisations vicieuses, rétractions tendineuses, parfois perte d'un membre).
Aucune antibiothérapie n'ayant prouvé son efficacité, le traitement qui permet, à l'heure actuelle, d'envisager la guérison la plus rapide et la moins mutilante est le traitement chirurgical (excision/greffe) à un stade précoce. Malheureusement, la méconnaissance de la maladie et des recours possibles conduit un trop grand nombre de malades à consulter à un stade tardif, ce qui a des conséquences socio-économiques très importantes, compte tenu du temps d'hospitalisation (8 mois en moyenne en Côte d'Ivoire) et des séquelles laissées par la maladie, qui font souvent des malades des handicapés à vie. En Côte d'Ivoire, selon Marston et al. [3], 63 % des patients se voient contraints d'arrêter leur travail ou de cesser de fréquenter l'école (l'ulcère de Buruli atteint surtout les enfants). La situation est d'autant plus préoccupante que la maladie touche en priorité les populations rurales, qui sont le moteur de l'économie de nombreux pays d'Afrique subtropicale.
I. Épidémiologie
L'ulcère de Buruli est, en terme de fréquence, la troisième mycobactériose dans le monde après la lèpre et la tuberculose. Dans certaines régions, l'ulcère de Buruli est en voie de supplanter la lèpre, en raison de la diminution du nombre de nouveaux cas de lèpre répertoriés annuellement et du progrès récent enregistré dans la lutte contre la lèpre [4]. L'ulcère de Buruli sévit dans les régions tropicales en foyers endémiques.
1. Distribution géographique et influence de l'environnement
L'ulcère de Buruli, qui sévit en foyers endémiques disséminés mais bien limités, en général situés dans des zones de marais, inondables, à proximité de lacs ou de cours d'eau, est une maladie ancienne et largement répandue dans le monde, qui semble connaître à l'heure actuelle une ampleur nouvelle par l'extension de ses foyers habituels et son incidence. Les modifications apportées par l'homme à l'environnement pourraient être à l'origine de cette nouvelle virulence de la bactérie.
La première description clinique de l'ulcère de Buruli date de 1948 et a été publiée en Australie [5]. En 1950, de nombreux cas sont décrits par Clancey en Ouganda dans la région du Buruli, qui donnera son nom à la maladie. Dès lors, d'autres cas sont identifiés en Afrique centrale (Cameroun, Zaïre), en Afrique de l'Ouest (Bénin, Côte d'Ivoire, Ghana, Liberia, Nigeria), en Asie (Indonésie, Malaisie), en Amérique (Guyane française, Mexique) et, plus récemment, au Togo [6] et en Angola [7].
La Côte d'ivoire est le premier pays à avoir fait de la lutte contre l'ulcère de Buruli une priorité nationale de santé publique (Un programme national de lutte contre les ulcères à mycobactéries a été mis en place par le ministère de la Santé de Côte d'ivoire en 1995.
La maladie y sévit aujourd'hui à l'état épidémioendémique dans quatre régions principalement, qui sont le Centre (Yamoussoukro), le Centre-Ouest (Daloa), le Centre-Nord (Bouaké) et le Sud-Ouest (San-Pedro). Dans la région centrale, 2 246 cas ont été identifiés et traités entre 1991 et 1994 dans les seuls dispensaires privés de Kongouanou (Centre), Zoukougbeu (Centre-Ouest) et Manikro (Centre-Nord), dont 694 (soit près d'un tiers) sont apparus en 1994. Le ministère de la Santé estimait à 4 000 le nombre de cas en traitement en 1995 sur l'ensemble du territoire [8] (À titre de comparaison, la Côte d'ivoire recensait 4 000 lépreux en traitement en 1995, dont 2 000 nouveaux cas).
Les quatre régions endémiques identifiées en Côte d'ivoire sont caractérisées par un climat de type tropical avec, particulièrement dans le Sud, des pluies abondantes en saison humide.
Ces régions ont subi de profonds bouleversements écologiques au cours des trente dernières années à la suite de nombreuses interventions humaines motivées par des raisons économiques. Le déboisement à des fins d'exportation y a été encouragé depuis 1960 (indépendance) et, malgré une baisse sensible de l'activité, l'exploitation forestière représente encore aujourd'hui une ressource économique non négligeable pour la Côte d'Ivoire.
Outre le phénomène généralisé de déforestation, la construction de grands barrages a contribué, à partir des années 70, à bouleverser les équilibres naturels. Il s'agit, d'une part, des barrages de Kossou et de Taabo sur le Bandama, dans la région Centre, respectivement mis en service en 1972 et 1979 et, d'autre part, du barrage de Buyo sur le fleuve Sassandra, mis en service en 1983 et couvrant une partie des régions Sud-Ouest et Centre-Ouest.
La région Centre (barrage de Kossou) est aujourd'hui l'un des principaux foyers d'ulcère de Buruli en Côte d'Ivoire, et le nombre de malades en provenance des villages aux alentours du barrage et se présentant au dispensaire de Kongouanou (Yamoussoukro), au sud du barrage, est en augmentation constante.
Quant au Centre-Ouest (Daloa), il s'agit de la région qui a vu apparaître les premiers cas d'ulcère de Buruli dans les années 80. De nombreux cas sont pris en charge aujourd'hui dans le dispensaire privé de Zoukougbeu, village situé au nord du barrage de Buyo (plus de 1 000 cas traités entre 1991 et 1994).
Dans d'autres pays aussi, l'apparition de cas d'ulcère de Buruli semble être en rapport avec des modifications apportées à l'environnement, comme au Nigeria, où des cas se sont déclarés chez des Européens sur le campus universitaire d'Ibadan à partir de 1965, date à laquelle a été créé un lac artificiel par interruption du cours d'une rivière [9]. Plus récemment, au Liberia, une apparition de cas a suivi l'introduction de cultures rizicoles [10].
Le cas de l'Australie est particulièrement frappant, puisque à la suite d'une recrudescence des cas entre 1992 et 1994 à Philipp Island (près de Melbourne), une enquête a révélé que les patients avaient été contaminés lors de la fréquentation d'un terrain de golf irrigué par un mélange d'eaux usagées et traitées et d'eaux en provenance du sous-sol. La révision du système d'irrigation en 1995 a permis d'enrayer l'apparition de ces cas [11].
Déforestation, construction de barrages ou de terrains de golf... les modifications apportées à l'environnement et bouleversant l'ordre naturel pourraient, en partie, expliquer l'apparition ou l'extension des foyers d'ulcère de Buruli. Or, les pays en développement, pour des raisons économiques, sont de plus en plus amenés à modifier leur environnement naturel et de nouveaux foyers d'ulcère de Buruli sont donc susceptibles d'apparaître dans les années à venir.
2. Réservoir et mode de transmission
Ni l'un ni l'autre n'ont jusqu'à présent été identifiés. Bien que l'environnement semble constituer la source de cette infection, et malgré de nombreuses recherches effectuées en particulier par Portaels [1, 2], Le bacille n'en a jamais été isolé jusqu'à présent.
Quant à la contamination et au mode de transmission, l'hypothèse privilégiée par de nombreux auteurs est l'inoculation directe à la faveur d'un microtraumatisme cutané qui permettrait à la bactérie de pénétrer dans la peau : coupures par herbes, piqûres par morceaux de bois, par insectes, par épines, morsures de poissons, vaccinations [12].
Cette hypothèse paraît être la plus probable, compte tenu de la localisation des ulcères, qui siègent principalement sur les parties du corps exposées, non protégées par des vêtements, surtout sur les membres.
3. Distribution en fonction de la race, de l'âge et du sexe
L'ulcère de Buruli peut atteindre tout le monde, sans distinction de race, d'âge, de sexe ou encore d'origine ethnique. Cependant, même si l'âge des patients varie d'un extrême à l'autre, on note une nette prédominance du groupe formé par les sujets jeunes, en âge de scolarisation. L'étude menée par Darie et al. en Côte d'Ivoire sur 124 cas [12] a mis en évidence une nette prédominance de l'atteinte des enfants, avec un pic entre 5 et 10 ans.
Il est admis par de nombreux auteurs que les enfants constituent une cible privilégiée de l'infection par M. ulcerans, soit qu'ils n'aient, compte tenu de leur âge, pas encore développé d'immunité antimycobactérienne, soit que leurs jeux les exposent de façon privilégiée au risque de contamination [13].
En revanche, il n'y a pas de certitude quant à une prédominance de l'affection chez les femmes par rapport aux hommes, quoique certains auteurs avancent l'hypothèse d'une contamination plus fréquente chez les femmes ; cette différence serait en liaison avec les activités saisonnières [14].
II. Diagnostic et description clinique
L'ulcère de Buruli est une mycobactériose cutanée dont l'agent est Mycobacterium ulcerans, une mycobactérie atypique opportuniste de la famille des bacilles acido-alcoolorésistants (BAAR), qui provoque des ulcérations cutanées caractérisées par une nécrose de la graisse hypodermique. M. ulcerans prolifère sous la peau et entraînerait la production d'une toxine qui inhiberait la phagocytose [15] et provoquerait la nécrose. M. ulcerans serait la seule mycobactérie capable de produire une telle substance. Cette mycobactérie a une température de croissance optimale entre 30 et 33 °C, d'où son tropisme sélectif pour le revêtement cutané qui a une température inférieure à 37°.
Les ulcères à M. ulcerans siègent principalement sur les membres, et surtout les membres inférieurs, mais toutes les parties du corps peuvent être atteintes. Le nombre et la taille des ulcères sont variables, même si l'on est amené, en règle générale, à traiter des ulcères de taille importante, parce que les patients viennent consulter tardivement.
1. Description des différents stades cliniques
D'après de nombreuses observations, l'incubation peut varier de quelques jours à quelques mois [16], voire quelques années (3 ans) [17] ; en moyenne, elle est de deux mois.
a. Phase de début (phase pré-ulcérative)
Elle peut revêtir deux formes :
- Nodulaire ou papulo-nécrotique.
Le plus souvent, il s'agit d'un seul nodule, invisible au début de son évolution mais qui se palpe parfaitement bien. Ferme, adhérant au plan superficiel cutané, il est libre et mobile par rapport aux plans profonds. Au cours de son évolution, il devient adhérent aux plans superficiel et profond et s'entoure d'un halo d'oedème, dur à la palpation; on ne palpe plus alors les limites du nodule. La peau en regard devient brillante, peut apparaître hyperpigmentée et prend un aspect desquamatif. Plus tard encore, au cours de l'évolution du nodule, la peau en regard du centre de la lésion (à l'endroit où la rupture qui va donner l'ulcération va se faire) devient rouge rosée, perdant sa pigmentation. Elle devient nécrotique pour finalement s'ulcérer. Dans d'autres cas, l'évolution peut se faire vers l'apparition d'une petite vésicule siégeant au centre de la lésion, qui peut se rompre et laisser s'échapper une petite quantité de liquide clair, pour Finalement évoluer elle aussi vers l'ulcère.Le nodule est habituellement non douloureux et passe donc souvent inaperçu ; il peut être occasionnellement prurigineux [18].
- Oedémateuse ou " fulminating lesion "
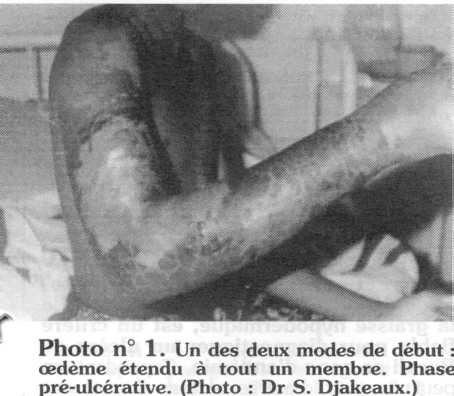
Un cedème douloureux, chaud, prenant un aspect de peau d'orange et qui donne à la peau en regard un aspect brillant et tendu, débute dans la zone où se fera l'ulcération. Cet oedème s'étend progressivement, pouvant prendre tout un membre quelquefois. La progression de cet oedème peut être très rapide [19]. Plus tard au cours de l'évolution, il devient plus facile de délimiter une zone indurée. La peau en regard desquame ; une bulle peut se former à la surface du revêtement cutané et se rompre pour évoluer vers l'ulcération [181. Il peut aussi apparaître une petite plaque violacée ou décolorée qui se nécrose et aboutit à un ulcère plus ou moins étendu [20] (photo n° 1).
b) Phase d'état
On observe une ulcération cutanée, unique ou multiple, d'évolution chronique et siégeant le plus souvent sur les membres. La forme de l'ulcère est arrondie, à contours polycycliques, plus ou moins réguliers et sa profondeur est constante. La peau en périphérie de l'ulcère est infiltrée, indurée, insensibilisée, hypo ou hyper pigmentée, polychrome, parfois desquamative et faisant douter de sa vitalité [12]. Les bords sont irréguliers, affouillés, décollés du plan musculo-aponévrotique par suite de la nécrose cellulo-adipeuse de l'hypoderme, creusés en profondeur avec une destruction des tissus sous-cutanés bien au-delà de ces bords ; ces tissus laissent la place à des coulées de gelée marron sale, résultant de la lipolyse et des bandelettes fibreuses remplaçant les logettes adipeuses [19].
La caractéristique de l'ulcère de Buruli réside dans le décollement des bords qui peut atteindre plusieurs centimètres et faire communiquer des ulcères satellites. La cicatrisation peut se faire à une extrémité de l'ulcère tandis que la nécrose se poursuit à l'autre bout [16].
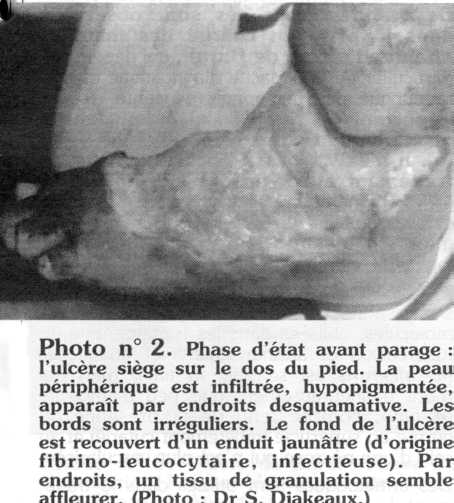
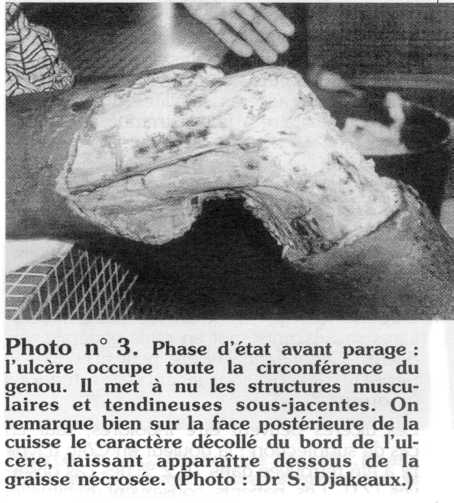
Le fond de l'ulcère est plus ou moins régulier, mais creusé uniformément et recouvert d'un enduit fibrino-leucocytaire jaunâtre, nauséabond et/ou d'un écoulement séro-purulent, qui se déterge lentement pour faire place à un tissu de granulation par endroits (photo n° 2). L'aponévrose profonde et les plans musculaires sous-jacents sont en règle générale respectés. Cependant, l'ulcère peut découvrir le périoste des os sous-jacents, les tendons (photo n° 3).
Les ulcères peuvent être indolores, sauf en cas de surinfection ; la douleur en Côte d'Ivoire a été retrouvée dans 70,2 % des cas observés [21]. Les patients conservent habituellement un bon état général [19] : il n'y a pas d'asthénie, de fièvre et d'adénopathies [22].
c) Phase de cicatrisation
L'ulcère peut évoluer durant des semaines, voire des mois. La cicatrisation peut se faire après détersion du fond de l'ulcère. L'épidermisation redémarre à partir des bords apparemment dévitalisés de l'ulcère, de façon centripète ; elle peut prendre plusieurs années pour les ulcères les plus vastes [12]. Quelquefois, tandis que l'épithélialisation se fait à un endroit, la.nécrose se poursuit à un autre, en particulier en aval sur le membre.
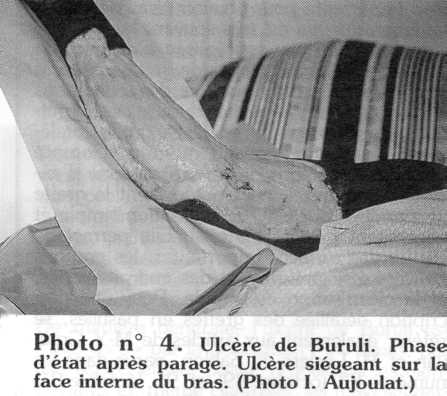
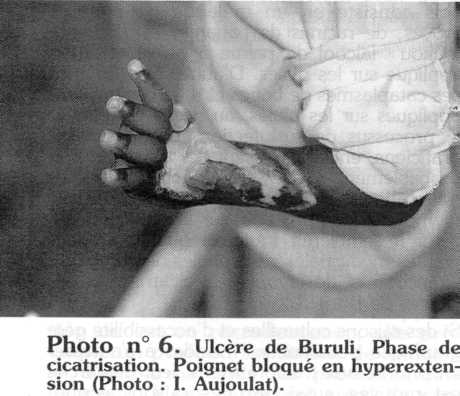
À l'heure actuelle, les malades consultant à un stade très tardif, la cicatrisation laisse très souvent des séquelles esthétiques et fonctionnelles pouvant entraîner une impotence fonctionnelle marquée. La cicatrice est fibreuse et rétractile [23]. L'évolution prolongée de l'ulcère en regard d'une articulation, avec les complications septiques qu'il peut entraîner, va causer des dommages irrémédiables à l'articulation, tels que des rétractions articulaires et tendineuses (raideur en flexion, en extension), des brides, des ankyloses [19]. Le coude, fréquemment touché, est alors en flexum, ainsi que le genou ou les doigts. Le poignet peut être bloqué en hyperextension (photo n° 6).
2. Diagnostic différentiel de l'ulcère de Buruli en phase d'état
L'aspect des bords de l'ulcère, affouillés et décollés par la nécrose de la graisse hypodermique, est un critère fiable pour diagnostiquer un ulcère de Buruli en zone d'endémie. Cependant, on peut évoquer d'autres ulcères devant ces lésions, et en particulier les ulcères phagédéniques : pyoderma gangrenosum. Il s'agit d'ulcères d'extension rapide mais dont les bords sont douloureux et parfaitement limités, formant un bourrelet inflammatoire dont le versant interne surplombe l'ulcère ; le versant externe rejoint en pente douce les téguments sains. Ces ulcères sont plus profonds que l'ulcère de Buruli, ils progressent rapidement et peuvent aller au-delà de l'aponévrose profonde et envahir les muscles, les tendons et même les os. L'état général des patients est en général altéré [24].
III. Traitement
De grandes disparités sont observées dans la prise en charge des malades atteints d'ulcère de Buruli, qui dépend en particulier de la capacité diagnostique et thérapeutique des personnels de santé. Il est important de signaler ici qu'en dehors du traitement chirurgical (excision/greffe), il n'existe pas à l'heure actuelle de traitement ayant prouvé son efficacité, et les soignants qui se trouvent confrontés à des cas d'ulcère de Buruli, qu'ils soient infirmiers, médecins, chirurgiens, dermatologues... se trouvent en général très démunis lorsque ces malades viennent consulter.
Des espoirs ont été suscités par certaines molécules, utilisées dans les traitements antituberculeux et antihanséniens et auxquelles M. ulcerans est sensible in vitro mais qui n'ont malheureusement que peu d'efficacité in vivo, compte tenu de la présence du germe en superficie (revêtement cutané) et au sein d'une nécrose qui n'est plus vascularisée.
Des antibiotiques sont utilisés dans le traitement des surinfections locales, mais n'ont pas d'effet sur M. ulcerans ou sur la toxine produite par la bactérie.
Des recherches sur une antibiothérapie associant plusieurs médicaments, en particulier des macrolides de dernière génération, sont en cours à l'Institut de Médecine tropicale d'Anvers (Portaels), mais la mise au point d'un traitement antibiothérapeutique doit aller de pair avec un diagnostic précoce de la maladie. En attendant la mise au point d'un tel traitement, le traitement chirurgical est le seul traitement efficace.
Ce traitement n'a pas fait jusqu'à présent l'objet d'un consensus. Les initiatives thérapeutiques sont restées souvent isolées et d'une grande disparité, les foyers de cette pathologie étant multiples et très dispersés. Des protocoles, qui doivent encore être discutés et évalués, ont été élaborés par les auteurs du Projet de lutte contre l'ulcère de Buruli en Côte d'Ivoire. Ces protocoles décrivent les gestes à effectuer à chaque stade de l'ulcère de Buruli (exérèse du nodule sous-cutané, parage de l'ulcère, greffe en pastilles, greffe dermo-épidermique mince, kinésithérapie postopératoire) et ont été rédigés dans le souci d'adapter des techniques opératoires correctes et efficaces et les pratiques actuelles, aux conditions humaines, matérielles et financières précaires du terrain, en particulier dans les zones rurales africaines où sévit l'ulcère de Buruli. Ils décrivent les différentes phases des interventions, leur préparation (salle, matériel et produits nécessaires), les soins infirmiers, y compris les pansements, et le suivi postopératoire.
À la phase pré-ulcérative, l'exérèse du nodule sous-cutané se fait en " fuseau " : le nodule est enlevé avec les tissus environnants, découpés suivant une forme de fuseau. Ce type d'ablation a l'avantage d'être rapide et simple du point de vue de la réalisation technique. L'excision des nodules permet d'en confirmer l'origine mycobactérienne après examen anatomo-pathologique et bactériologique de la pièce opératoire, leur aspect clinique n'étant pas spécifique.
À la phase d'état, le traitement chirurgical, qui consiste en un parage de l'ulcère suivi d'une greffe de peau est efficace, à condition que l'exérèse des tissus s'étende bien en périphérie des ulcères, jusqu'en zone saine et bien vascularisée. Une exérèse limitée entraîne immanquablement des " rechutes " comme en témoigne notamment une expérience récente menée en Allemagne sur un enfant angolais, qui a dû être hospitalisé plusieurs mois et subir trois opérations avant de pouvoir cicatriser [7]. Dans ce cas, l'exérèse des tissus a probablement été limitée dans le souci d'économiser la peau en périphérie de l'ulcère. Or, on sait que la nécrose se poursuit bien au-delà des berges de l'ulcère. En pratique, pour estimer la surface de tissus à enlever, on peut enfoncer un stylet sous les bords de l'ulcère jusqu'à buter contre les parois de l'ulcère ; marquer la peau à 2 cm au-delà de cette paroi et tracer ainsi " l'encadrement " de l'ulcère, qui sera la limite de l'exérèse [25] (figure n° 1).

Le parage consiste donc à réaliser l'exérèse large des bords et la détersion du fond de l'ulcère (Photo 4 et 5). L'exérèse permet d'enlever les tissus nécrosés ou en voie de nécrose. Quant à la détersion, elle consiste à gratter et à enlever l'enduit fibrino-leucocytaire jaunâtre, nauséabond, qui tapisse le fond de l'ulcère. Lorsque la perte de substance est trop importante pour pouvoir cicatriser spontanément (ce qui est très souvent le cas), une autogreffe de peau est réalisée à distance de l'excision. Différents types de greffes peuvent être envisagés, en fonction des conditions d'exercice et des capacités du praticien : greffe en pastilles, greffe en filets, greffe totalement couvrante, cousue ou non. Compte tenu des conditions d'exercice en zone d'endémie, certains auteurs préconisent la greffe en pastilles [20, 21], de réalisation simple et nécessitant peu de matériel. Elle permet de greffer des surfaces importantes, les greffons peuvent être prélevés en des endroits variés, et la cicatrisation est rapide. Pour une description détaillée des greffes en pastilles, se référer également aux articles de M-Y Grauwin et M. Leclerc du Sablon.
Enfin, la cicatrisation des ulcères, notamment en regard des articulations, pouvant entraîner des rétractions tendineuses et des déformations importantes à l'origine de handicaps fonctionnels marqués, la pratique d'une kinésithérapie quotidienne (mobilisation passive et active des articulations) est nécessaire pour limiter, sinon empêcher l'installation de ces séquelles.
IV. Médecine traditionnelle et représentations
Dans de nombreux pays, les malades continuent à préférer la médecine traditionnelle à toute autre forme de prise en charge. En Côte d'Ivoire, l'un des traitements traditionnels consiste en un mélange de piments broyés, de racines de bananier et de " koutoukou " (alcool de palme à 80° !) que l'on applique sur les plaies. D'autres fois, ce sont des cataplasmes de boues et d'herbes qui sont appliqués sur les plaies, au risque d'aggraver le processus de surinfection. D'autres tradipraticiens, encore, utilisent des substances probablement à base de chaux qui, si elles neutralisent l'ulcère, perforent aussi le membre, y compris l'os, sur lequel siège l'ulcère. Il semblerait toutefois qu'il existe des plantes médicinales susceptibles de combattre l'infection et de favoriser la cicatrisation des ulcères de Buruli [26].
Si des raisons culturelles et d'accessibilité géographique poussent les malades à s'adresser en priorité aux tradipraticiens, leur démarche est motivée aussi par des raisons économiques. En effet, le coût du traitement, qui comprend au minimum le coût des médicaments et des pansements ainsi qu'un forfait d'hospitalisation sur plusieurs mois, est très élevé et reste inaccessible pour la plupart, d'autant plus que ce sont essentiellement les populations rurales qui sont touchées par l'ulcère de Buruli. S'ajoute au prix du traitement le poids économique d'une immobilisation prolongée d'un ou plusieurs membres d'une même famille, qui sont souvent des personnes jeunes qui se voient ainsi empêchées de participer aux travaux des champs par exemple, ce qui a pour effet de désorganiser la vie de la communauté.
De manière générale, l'ulcère de Buruli est "mal vécu " par la population : les plaies, par leur aspect et leur odeur, repoussent les bien-portants et, même cicatrisés, les malades gardent des stigmates de leur maladie et souffrent de différentes complications articulaires et fonctionnelles qui sont invalidantes pour leur vie quotidienne. Mais surtout, la maladie fait peur... la méconnaissance totale des modes de transmission, ainsi que la progression rapide de la maladie effraient, et on a recours, pour se protéger et justifier son attitude de rejet, à des représentations et explications irrationnelles, mêlant esprit de vengeance et sorcellerie. Ainsi, en Côte d'Ivoire, à la fin des années 80, quand les premiers cas ont fait leur apparition dans la région de Daloa (Centre-Ouest), il était courant de parler de " la maladie mystérieuse de Daloa ", " la maladie du sort ", " la maladie du sorcier qui se mange lui-même "...
À titre anecdotique, dans les centres de prise en charge des lépreux - traditionnellement considérés comme les malades les plus " déshérités du sort", " les parias de l'humanité " - où les malades du Buruli sont parfois accueillis, il est intéressant de noter que les malades de la lèpre considèrent avoir de la chance de " n'être que lépreux... parce que l'autre maladie, c'est pire ! "
V. Recommandations
Il est important de bien comprendre qu'il n'existe pas à l'heure actuelle, outre le traitement chirurgical, de traitement de l'ulcère de Buruli ayant fait la preuve de son efficacité et que, partout où cette maladie fait son apparition ou est en recrudescence, elle provoque un profond sentiment de malaise et d'embarras chez les professionnels de santé. Il est important aussi de rappeler et de souligner que les cas d'ulcère de Buruli sont loin d'être des cas isolés et que, sans parler des conséquences médicales et humaines de la maladie, le poids social et économique que représente cette maladie pour les pays endémiques est très lourd à porter, tant pour les populations exposées, que pour les soignants ou les autorités sanitaires.
Il est essentiel de concentrer les efforts sur un dépistage précoce des cas, à un stade où l'ablation des nodules ou l'exérèse des tissus peut être envisagée sans qu'une greffe de peau - toujours très lourde à réaliser, en particulier dans un contexte de développement - ne soit nécessaire, et avant que les séquelles de la maladie ne soient devenues irréversibles.
Or, il ne peut pas y avoir de dépistage précoce sans sensibilisation des populations exposées et sans information et formation des professionnels de la santé des pays concernés, en particulier dans les centres de santé ruraux, qui sont en contact le plus direct avec les populations touchées par l'ulcère de Buruli.
En l'absence de moyens pour un véritable projet de recherche multidisciplinaire et international, il est donc nécessaire que les professionnels de la santé et les ONG qui interviennent dans les pays où l'ulcère de Buruli sévit à l'état épidémo-endémique se mobilisent pour favoriser un dépistage précoce des cas, comme cela a été fait il y a quelques années, avec la formation d'équipes mobiles pour dépister les cas de lèpre, par exemple. Dans le cas de l'ulcère de Buruli en effet, l'expérience de l'Australie en particulier a montré que le traitement chirurgical à un stade précoce (ablation des nodules) était, en attendant qu'une solution plus satisfaisante puisse être trouvée, un traitement efficace [27].
Il est urgent également de créer les conditions d'un échange entre les professionnels de différentes disciplines et de différents pays, pour progresser dans la connaissance et la maîtrise du fléau que représente l'ulcère de Buruli. En effet, si le réservoir et le mode de transmission de M. ulcerans demeurent mystérieux, et la physiopathologie de la maladie encore peu connue, un certain nombre de connaissances, en termes de pratiques comme de représentations, ont déjà été acquises par de nombreux professionnels, et il est nécessaire de mettre en commun ces connaissances, en vue d'une meilleure prise en charge des malades.
Pour cela, à l'initiative du Professeur F. Portaels, Chef du département de microbiologie à l'Institut de Médecine tropicale d'Anvers, un réseau international et multidisciplinaire, le MUST (Mycobacterium Ulcerans Study Team) est en train de se constituer pour que les professionnels puissent échanger leurs points de vue, dans un premier temps au travers d'un bulletin d'information, sur les pratiques et les connaissances qu'ils ont acquises sur I'ulcère de Buruli.
L'ulcère de Buruli est encore largement méconnu et très souvent considéré comme une maladie marginale. Tout témoignage permettant de mieux comprendre la maladie et de confirmer son ampleur, est précieux. Que vous soyez infirmier, médecin généraliste, dermatologue, chirurgien, gestionnaire de programmes de santé.... n'hésitez pas à témoigner de votre expérience en écrivant à la revue. Si vous rencontrez une difficulté particulière et que vous souhaitez être conseillé, le MUST essaiera de vous apporter une réponse et de vous mettre en rapport avec des professionnels susceptibles de vous aider.
Références bibliographiques
[1] Portaels F. Epidemiology of mycobacterial diseases. In Clinics in dermatology. M. Schuster (ed), 1995 : 13.
[2] Portaels F. Épidémiologie des ulcères à Mycobacterium ulcerans. Ann Soc Belg
Med Trop 1989 ; 69 : 91-103.
[3] Marston BJ, Diallo MO, Horsburgh R, Diomande 1, Saki MZ, Kanga JM, G'Bery P, Lipman HB, Ostroff SM, Good RC. Emerqence of Buruli ulcer disease in Daloa region of Côte d'Ivoire. Am J Trop Med Hyg 1995; 52: 219-24.
[4] Nordeen SK. Trans R Soc Trop Med Hyg 87: 515-7.
[5] McCallum P. A new mycobacterial infection in man : clinical aspects (chap. I). J Path Bact 1948 (a); 60: 93-102.
[6] Meyers WM, Tignokpa N, Priuli GP, Portaels F. Mycobacterium ulcerans infection (Buruli ulcer) : first reported patients in Togo. Br J Dermatol 1996 ; 134: 1116-21.
[7] Bär W. M. ulcerans infection in Angola. Conference on global lung health and the 996 annual meeting of the International Union against Tuberculosis and Lung Disease (IUATLD), Paris, 1996.
[8] Kanga J-M. Projet de création d'un comité national de lutte contre les ulcères à mycobactéries. CHU de Treichville, mars 1995, Abidjan, Côte d'Ivoire, 12 pages.
[9] Hayman J. Mycobacterium ulcerans infection. Lancet 1991 ; 337 : 124.
[10] Fjayman J. Postulated epidemiology of Mycobacterium ulcerans infection. Int J Epidemiol 1991 ; 20: 1093-7.
[11] Johnson PDR, Veitch MGK, Leslie DE, Flood PE, Hayman JA. The émergence of Mycobacterium ulcerans infection near Melbourne. Med J Aust 1996 ; 164 (2) : 76-8.
[12] Darie H, Le Guyadec T, Touze JE. Aspects épidémiologiques et cliniques de l'ulcère de Buruli en Côte d'Ivoire (à propos de 124 observations récentes). Bull Soc Pathol Exot 1993 ; 86 : 272-6.
[13] Josse R, Guedenon A, Darie H, Anagonou S, Portaels F, Meyers WM. Les infections cutanées à Mycobacterium ulcerans : ulcères de Buruli. Med Trop 1995: 364-73.
[14] Revill WDL, Barker DJP. Seasonal distribution of mvcobacterial skin ulcers. Br J Preu Soc Med 1972 ; 26 : 23-7.
[15] Hockmeyer WT, et al. Infect Immun 1978; 21 : 124-8.
[16] Radford AJ. Mycobacterium ulcerans infections in Papua New Guinea. Papua New Guinea Med J 1974 (d) ; 17 : 145-9.
[17] Meyers WN, et al. Mycobacterium ulcerans infection (Buruli ulcer).
[18] Uganda Buruli Group. Clinical features and treatment of pre-ulcerative Buruli lesions (Mycobacterium ulcerans infection). Br Med J 1970 2 : 390-3.
[19] Cornet L, Richard-Kadio M, N'Guessan HA, Yapo P, Hossoko H, Dick R, Casanelli JM. Le traitement des ulcères de Buruli par excision-greffe. Bull Soc Pathol Exot 1992 ; 85 : 355-8.
[20] Richard-Kadio M, Dick R, Djeha D, Kossoko H, Kanga J-M, N'Guessam HA, Heroin P, Cornet L. Place de la greffe dermo-épidermique dans le traitement des ulcères de Buruli. CHU de Treichville, Abidjan, Côte d'Ivoire, 16 pages.
[21] Darie H, Djakeaux S, Cautoclaud A. Approche thérapeutique des infections à Mycobacterium ulcerans. Bull Soc Pathoi Exot 1994 87 : 19-21.
[22] Josse R, Andres L, Zinsou C, Anagonou S, Guedenon A, Botineau M, Catraye J, Foundohou J, Touze JE. Étude clinique et épidémiologique de l'ulcère de Buruli chez le jeune au Bénin. Cahiers Santé 1992 ; 2 : 23-7.
[23] Perraudin ML, Herrault A, Desbois JC. Ulcère cutané à Mycobacterium ulcerans (ulcère de Buruli). Ann Pediatr 1980 ; 27 (10): 687-92.
[24] Hayman J. Skin ulcération in the Tropics. Trop Surg 1995 : 8-10.
[25] Huguet MP, Aujoulat I, Koïta Y. Proposition de protocoles de traitement adaptés à des conditions d'exercice précaires. Projet de lutte contre l'ulcère de Buruli en Côte d'Ivoire, Centre R.- Labusquière, Université Bordeaux Il, 1995.
[26] Guedenon A, Zinsou C, Andele K, Josse R, Pritze S, Portaels F, Meyers WM. Traditional treatment of Bun-di ulcer in Benin. Arch Dermatol 1995.
[27] Hayman J. (Communication personnelle.)
Développement et Santé, n° 125, octobre 1996